佐剂一词源自拉丁语单词ad和juvare,意思是“帮助”。佐剂的作用是帮助引导共同给药的疫苗抗原产生保护所需的免疫反应。由于对其作用机制的了解不足,新的佐剂开发一直举步不前。最近,Toll样受体(TLRs)的发现彻底改变了这一领域,TLRs是一种先天免疫受体,直接或间接负责检测病原体相关分子模式(PAMP),并通过激活先天和适应性免疫途径对其作出反应。
天然存在和合成的TLR激动剂可以利用这些内源性免疫信号通路来增强和调节疫苗反应,从而使其成为优良的疫苗佐剂。这不仅对开发针对传染病的疫苗具有重要意义,而且对针对癌症、过敏、阿尔茨海默病和其他疾病的免疫疗法也具有重要意义。每种TLR都有自己的特定组织定位和下游基因信号通路,TLR激动剂可以与其他TLR或替代佐剂组合,以产生具有协同或调节作用的组合佐剂,这为研究人员提供了精确定制具有特定免疫效果的佐剂的机会。
TLR受体家族包含六种跨膜TLR(TLR-1、2、4、5、6和10)和四种定位于内涵体膜的TLR(TLC-3、7、8和9)。每种PAMP都被不同的TLR识别,即脂多糖(TLR4)、脂肽(TLR2与TLR6或TLR1)、鞭毛蛋白(TLR5)、单链RNA(TLR7/8)、双链RNA(TLR3)和含CpG基序的DNA(TLR9)。
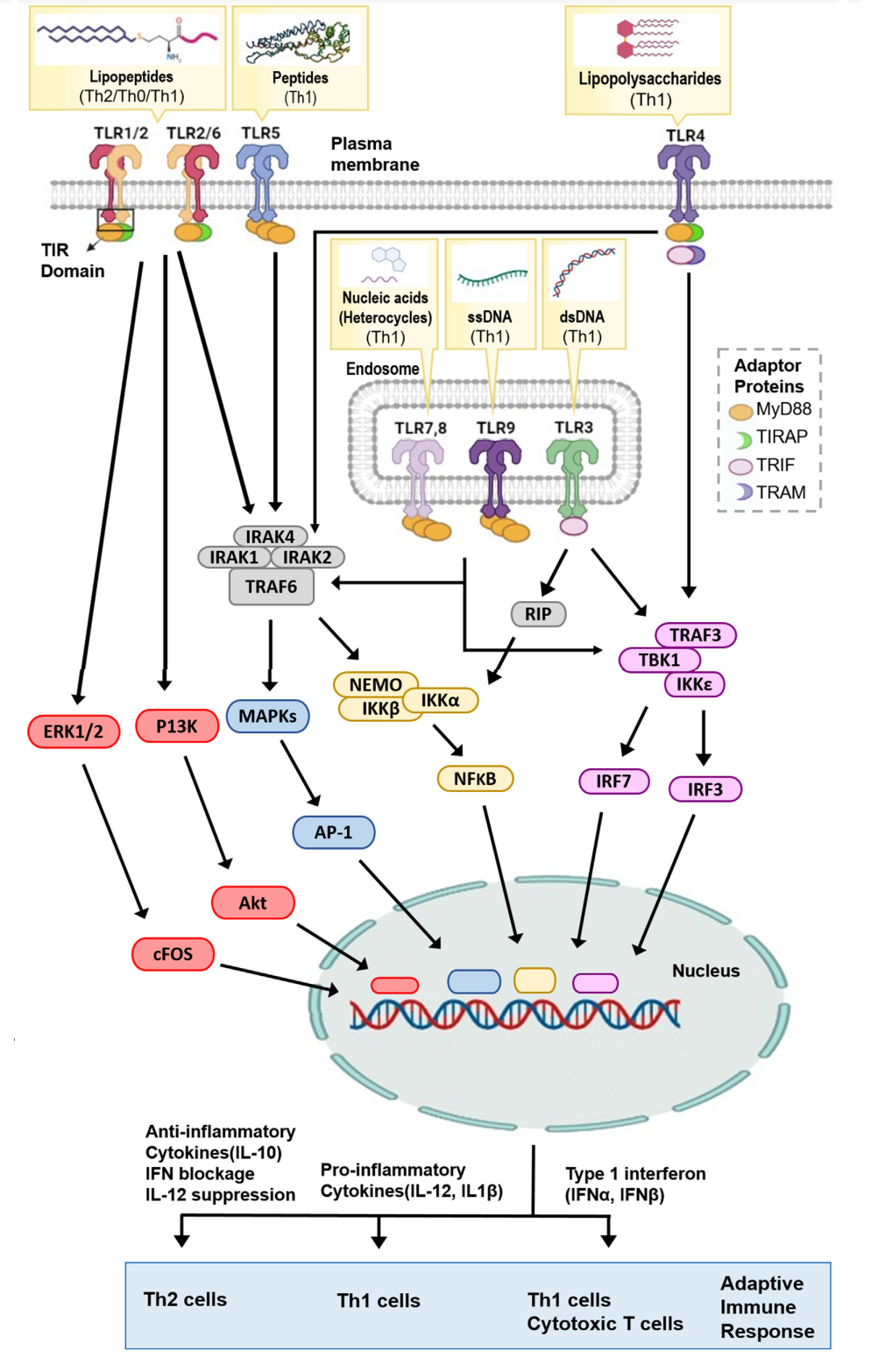
在遇到特定的PAMP时,TLRs形成同源二聚体(TLR3、TLR4、TLR5、TLR7、TLR8和TLR9)或异二聚体(TLC1/2或TLR2/6)。配体诱导的TLRs二聚化使得衔接蛋白(MYD88)能够结合到TIR结构域。TLR3比较特别,该蛋白作为TLRs的通用衔接蛋白,利用含有TIR结构域的诱导干扰素-β蛋白(TRIF)作为适配器蛋白。TLR受体和衔接蛋白的多样性意味着TLR可以参与启动许多不同的下游免疫途径。
TLRs的激活可以调节疫苗产生的免疫反应类型。反应类型由特定TLR及其衔接蛋白激活的信号通路决定。一般来说,大多数TLR途径导致Th1免疫反应,但TLR2除外,可能由于TLR2配体的多样性,TLR2可以诱导促炎和抗炎途径,导致Th1、Th0或Th2免疫反应。
除TLR3外,大多数TLR通过MyD88发挥作用。TLR激活后,MyD88募集由IL1受体相关激酶(IRAK)1、IRAK2和IRAK 4组成的寡聚复合物,并激活MyD88 TNF受体相关因子6(TRAF6)。活化的TRAF6随后触发核因子κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)途径,从而诱导促炎细胞因子,如IL-12和TNF-α。TLR7和TLR9可以激活TRAF3磷酸化干扰素调节因子7(IRF7),从而产生IFN-α。此外,TLR3和TLR4已被证明通过其TRIF衔接蛋白募集TRAF3来诱导IFN-β的产生,从而激活IRF3。I型IFN应答可诱导强Th1细胞/细胞毒性T细胞(CTL)应答,该应答对鉴定和清除感染或癌细胞很重要。TLR2受体主要诱导以高IL-10产生和低IL-12为特征的强Th2免疫反应。
TLR并不专门触发Th1或Th2途径,而是可以影响多种途径。正是信号事件的平衡决定了免疫偏向。例如,一项研究表明,TLR4和TLR2激动剂的激活可以通过p38 MAPK和ERK1/2-FOS途径刺激信号传导,分别导致IL-12或IL-10的产生;然而,TLR4在比TLR2更高的阈值下诱导p38 MAPK信号传导,而TLR2在比TLR4更高的阈下诱导ERK1/2信号传导,导致免疫极化。
TLRs协调了从免疫细胞迁移到增强抗体亲和力成熟的许多功能。TLRs作为危险信号传感器,增加了免疫细胞向疫苗给药部位的运输。TLR参与可增强I类和II类MHC分子的抗原捕获、处理和呈递。某些特定类型的TLR可以不同程度地影响抗原的交叉呈递,从而TLR3或TLR4,而不是TLR2或TLR7/8配体,减少CD8 +T细胞对抗原的摄取和交叉呈递。TLR激活也可导致共刺激分子(如CD80和CD86)的上调,这对APC启动幼稚T细胞至关重要。DC细胞的TLR在自我/非自我抗原识别以及是产生免疫反应还是免疫耐受中起着关键作用。不同类型的APC表达不同的TLR,例如髓系DC表达TLR2和TLR4,而浆细胞样DC(pDC)表达TRL7和TLR9。因此,TLR对不同DC谱系的优先激活可以影响随后的免疫偏向。
与小鼠相比,TLR在B细胞上的表达在人类中更为有限,人类主要表达TLR 2、7、9、10,TLR2配体需要通过B细胞受体(BCR)和TLR7的交联进行额外增敏,TLR7需要1型干扰素(IFN)引发。这些TLR激动剂在体外诱导B细胞的增殖、活化和分化。最初,人们认为TLRs只促进B细胞的卵泡外反应,其特征是快速产生低亲和力抗体;然而,最近的研究表明,TLRs也可以增强生发中心反应,从而产生高亲和力抗体。TLR与BCR协同作用,诱导类转换重组和抗体反应的成熟。TLR4还增强了B细胞向引流淋巴结的迁移,并在此过程中加快了抗体类别的转换。不适宜的B细胞TLR信号传导与自身反应性B细胞和自身免疫性疾病的产生有关;因此,在疫苗配方中避免过度的TLR刺激非常重要。
TLR也已被证明能增强各种不同的T细胞亚群。几项研究表明,TLRs可以作为CD8+T细胞的共刺激分子,促进细胞增殖/存活、效应器功能、细胞因子产生和记忆形成的增加。TLRs在Treg细胞中的作用仍然存在争议。几项研究表明,TLR2激动剂可诱导Treg抑制活性的暂时丧失;而其他研究表明,尽管TLR2激动剂可增加抗原特异性增殖,但Treg细胞仍保留其抑制功能。
疫苗配方中使用的TLR激动剂有多种形式,从脂肽到单链DNA和RNA。下面介绍TLR佐剂的主要类别。
TLR2
TLR2在多种细胞表面表达,包括单核细胞、巨噬细胞、内皮细胞、上皮细胞、自然杀伤细胞、树突状细胞、髓系抑制细胞、血小板和肥大细胞。TLR2识别的PAMP库是最广泛的,因为它能够与TLR1和TLR6(以及人类中的TLR10)形成异二聚体。
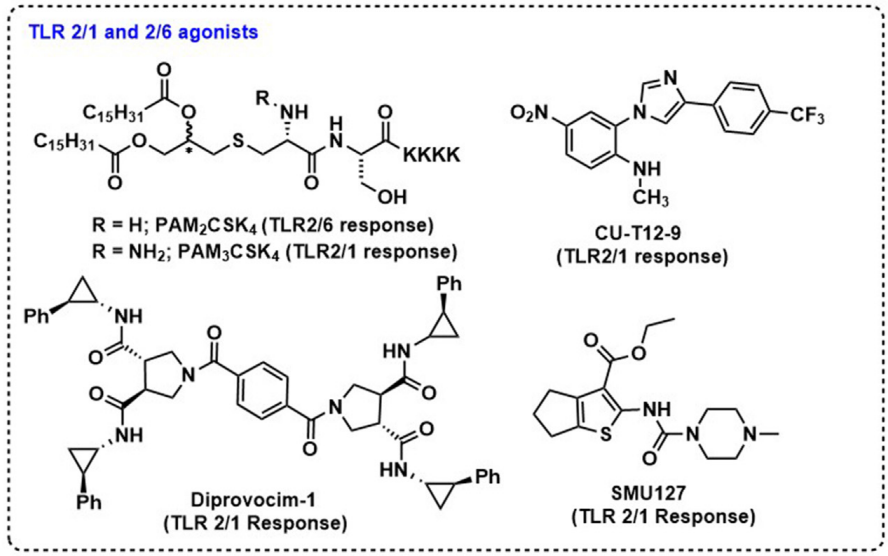
TLR2佐剂的范围很广,包括合成脂肽(PAM3CSK4和PAM2CSK4)、阿拉伯甘露糖脂、脂磷壁酸、GPI膜锚定物、酵母多糖和肽聚糖。近年来TLR2研究的主要趋势包括发现小型合成TLR2激动剂、改进传统TLR2激动物的特性以及TLR2与疫苗抗原的生物偶联。例如,XS15(PAM3CS-GDPKHPKSF)是一种新的基于PAM3CS的TLR-1/2激动剂,其中PAM3CSK4的四赖氨酸(K4)被九肽(GDPKHPKSF)取代,以改变偶联物的水溶性,不仅促进摄取,而且易于纯化。使用TLR2激动剂作为佐剂的局限性包括大多数配体的大小、复杂性和疏水性。
TLR3
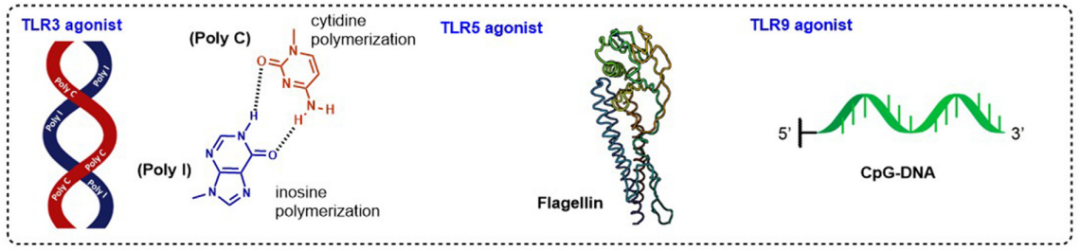
TLR3是一种细胞内识别系统,对病毒核酸(dsRNA、ssRNA和ssDNA)以及内源性双链RNA作出反应。已经开发了许多TLR3激动剂,如RGC100和ARNAX,一种合成的DNA-RNA杂交化合物。然而,在过去两年中,研究人员又回到了使用传统的dsRNA模拟配体,如poly IC,重点是改进其递送模式和新的疾病应用。
TLR4
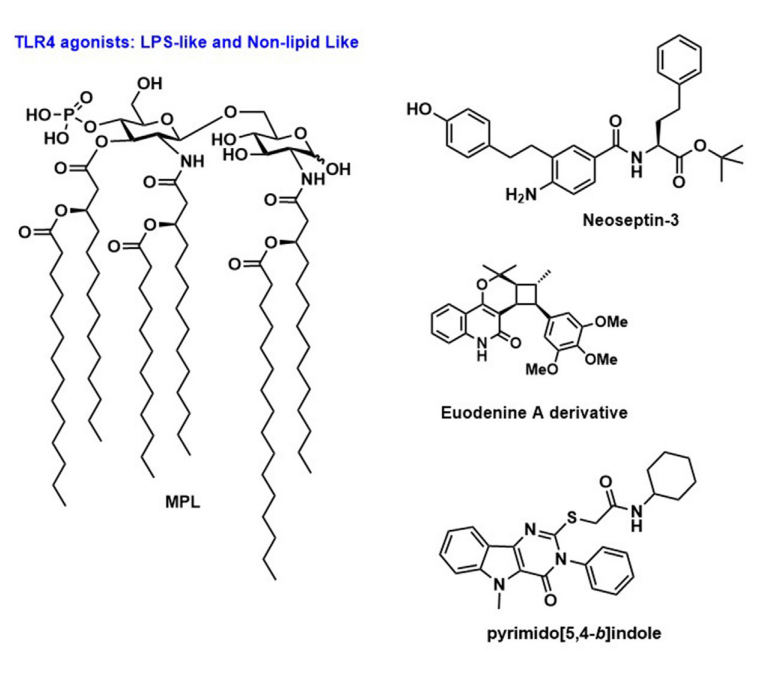
TLR4是TLR家族中研究最多的成员,它识别脂多糖(LPS)。TLR4位于质膜上,主要在髓系细胞上表达,而pDCs和幼稚B细胞不表达。TLR4通过其共受体骨髓分化因子-2(MD-2)和CD14识别LPS。最近关于TLR4激动剂的工作集中在修饰产物的开发和评估上,如单磷酸脂质A(MPLA)和吡喃葡萄糖脂质A(GLA),它们在结构上与LPS相关,但没有高致热原性并保持强免疫增强特性,从而增加了其临床应用的可行性。
TLR5
TLR5识别鞭毛蛋白,并在上皮细胞和免疫细胞(如巨噬细胞和未成熟DC)上表达,通过MyD88依赖性信号通路产生免疫反应。最近关于TLR5激动剂的工作主要集中在提高耐受性上。不幸的是,鞭毛蛋白会诱导不必要的过度反应原性,作为一种蛋白质,它可以诱导针对自身的抗体,干扰其作为佐剂的功能。有研究通过从鞭毛蛋白中去除B细胞表位区域解决了这一问题,脱免疫的鞭毛蛋白保留了其TLR5佐剂活性。
TLR7/8
TLR7和TLR8位于免疫细胞的内涵体膜上。TLR7主要在pDC和B细胞中表达,而TLR8在髓系树突状细胞、单核细胞中表达,在pDC中表达程度较低。TLR7/8识别单链核糖核酸(ssRNA),并通过MyD88依赖性途径发出信号。在天然配体中,富含腺苷和尿苷的寡核苷酸(ORN)能够激活TLR8,而对TLR7没有任何影响,而富含鸟苷的ORN激活TLR7和TLR8依赖性信号传导。TLR7以单体形式存在,并在配体存在下二聚,而TLR8以天然存在的弱二聚体存在,在配体结合时发生构象变化。目前已发现15种以上的新型杂环分子,如咪唑喹啉、蝶呤、嘧啶、吡啶嘧啶、吡咯嘧啶和苯并咪唑,被鉴定为TLR7/8激动剂。
TLR7/8激动剂的一个常见缺点是反应原性,近年来,有大量研究试图克服这些副作用。将TLR7/8激动剂封装在基于阳离子DOEPC的脂质体制剂纳米颗粒中,或将这些小分子共价连接到超支化聚合物上,可以避免其有害的系统反应,同时保持其对体液免疫的影响。
TLR9
TLR9在细胞内定位于内涵体膜中,识别细菌和病毒DNA的单链非甲基化CpG寡核苷酸。TLR9在免疫细胞上表达,如树突状细胞、巨噬细胞、自然杀伤细胞和其他APC。合成CpG序列可用作TLR9激动剂,以增强疫苗的免疫反应,并且每种独特的序列变异组合已被证明具有不同的结构和生物学特性。
TLR9激动剂在过去两年中的最新发展主要集中在CpG向细胞的有效递送和摄取上。例如,一项研究介绍了一种将CpG-ODN偶联到新型阳离子脂质体上的新方法,该复合物能够在低抗原和佐剂剂量下诱导强烈的免疫反应。
组合TLR佐剂
将不同TLR的激动剂组合在单一疫苗中产生协同效应,可以驱动强大的疫苗免疫反应。例如,包含1V270(TLR7激动剂)和2B182C(TLR4激动剂)的脂质体佐剂诱导了针对流感的平衡的抗HA和抗NA IgG1和IgG2a反应,而没有Th1促炎反应常见的过度反应原性。类似地,一项研究评估了卵清蛋白(OVA)与两到三种TLR配体的十种独特组合的共包封,包括Pam3CSK4(TLR2激动剂)、MPLA(TLR4激动剂),咪喹莫特(TLR7/8激动剂)和CpG(TLR9激动剂),而三重组合以总体平衡的Th1/Th2应答促进抗原特异性抗体滴度。因此,TLR佐剂的组合可以提供广泛的定制免疫反应。
TLR激动剂与其他PAMP如NOD2和巨噬细胞诱导型Ca²的组合⁺-依赖性凝集素受体(Mincle)配体也很有前景。共价连接CL239(TLR7激动剂)和胞壁酰二肽(NOD2激动剂),并将双激动剂作为纳米颗粒与NP-p24 HIV疫苗结合,协同作用增强了对小鼠的保护。
TLR激动剂利用内源性先天免疫途径增强疫苗适应性免疫反应。在过去两年中,佐剂领域一直被新冠肺炎疫苗的研究所主导。这一流行病的推动力迅速推动了佐剂领域的发展,多种新佐剂现已被纳入许可的新冠肺炎新疫苗中。除了新冠肺炎,对更有效佐剂的需求继续增长,特别是在癌症和疟疾、结核病和艾滋病毒等难以预防的传染病领域。解开TLR联合佐剂背后的作用机制,再加上更多的安全性和有效性研究数据,有助于推动下一代佐剂平台的发展。
参考文献:
1.Toll-like receptor (TLR) agonists as a driving force behind next-generation vaccine adjuvants and cancer therapeutics. Curr Opin Chem Biol.2022 Oct;70:102172






