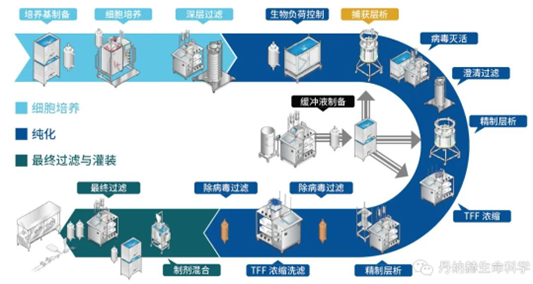
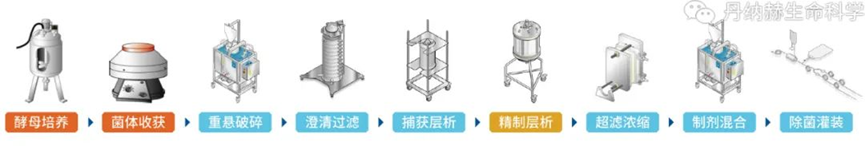
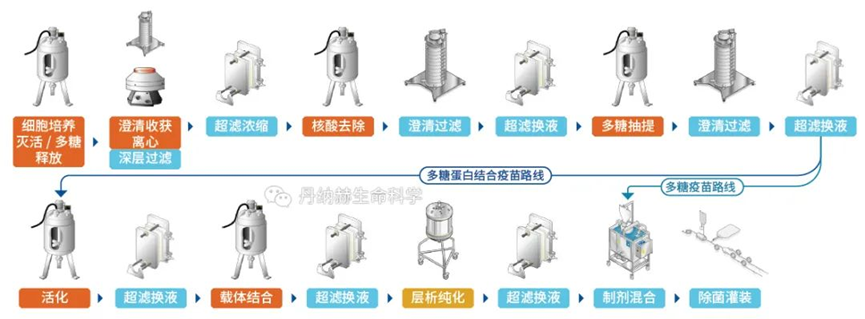
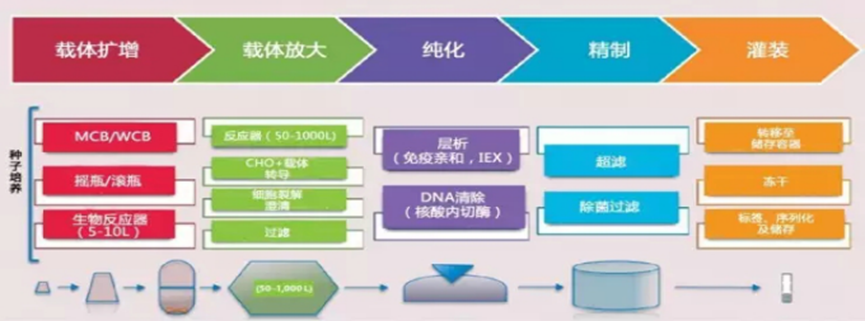
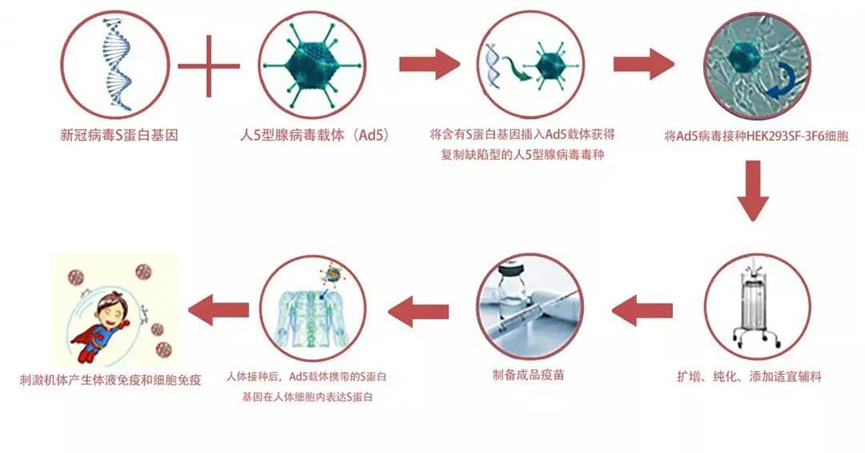
疫苗是预防和控制传染病最经济、有效的手段,疫苗接种是通过诱导机体产生保护性免疫应答来预防和控制人类和动物疾病的常规方法。疫苗技术已经从以巴斯德原则的病原体“分离、灭活和注射”发展到基于基因工程、免疫学、结构生物学、反向疫苗学和系统生物学融合的现代疫苗技术,正在向着癌症、自身免疫病和其他慢性疾病等领域拓展。面对当今重大、复杂、突发、高变病原体,传统疫苗学方法难以满足需求,而且还有部分重大感染性疾病的疫苗品种,如针对HIV、结核杆菌、疟原虫和其他广泛传播的病原体的疫苗尚未研发成功,新型疫苗技术是应对未来全球健康挑战的有利武器。本文主要梳理了当前各类热点技术疫苗生产工艺,仅供学习参考。重组蛋白疫苗工艺是一种新型的疫苗制备技术,它利用基因工程技术将病原体的特定蛋白基因克隆到表达载体中,通过大规模的细胞培养和纯化技术制备出高纯度的蛋白质疫苗。相比传统的灭活疫苗和活疫苗,重组蛋白疫苗具有安全性高、稳定性好、易于生产等优点,已经成为当前疫茧研究的热点之一。1.基因克隆:将病原体的特定蛋白基因克隆到表达载体中,构建重组表达载体。2.细胞培养:将重组表达载体转染到宿主细胞中,通过细胞培养技术大规模生产重组蛋白。3.蛋白纯化:通过离心、层析、电泳等技术将重组蛋白从细胞培养液中纯化出来,得到高纯度的蛋白质疫苗。4.疫苗制备:将纯化后的重组蛋白与适当的佐剂混合,制备成疫苗。重组蛋白疫苗的制备过程相对复杂,需要高水平的技术和设备支持。但是,相比传统的灭活疫苗和活疫苗,重组蛋白疫苗具有更好的安全性和稳定性,能够有效预防多种传染病,如乙肝、流感、艾滋病等。VLP疫苗生产工艺是- -种新型的疫苗生产技术,它是利用基因工程技术将病毒的外壳蛋白表达出来,形成类似于病毒的颗粒,这些颗粒被称为病毒样颗粒(VLP),它们具有与真正的病毒相同的外形和结构,但是不含有病毒的核酸,因此不会引起疾病。VLP疫苗具有很高的安全性和兔疫原性,已经被广泛应甩于预防多种传染病,如乙型肝炎、人乳头瘤病毒感染等。1.基因克隆:首先需要将病毒的外壳蛋白基因克隆到表达载体中,这个过程需要利用PCR技术扩增目标基因,并将其插入到表达载体中。2.细胞培养:将表达载体转染到宿主细胞中,使其表达外壳蛋白基因,产生VLP颗粒。常用的宿主细胞包括酵母、昆虫细胞、哺乳动物细胞等。3.纯化和提取:将细胞培养液进行离心、过滤等操作,将VLP颗粒从细胞碎片、蛋白质等杂质中分离出来。常用的纯化方法包括超速离心、柱层析、电泳等。4.疫苗制备:将纯化后的VLP颗粒进行灭活、加工等处理,制备成疫苗。常用的加工方法包括冻干、混悬液等。如果表达系统表达的是单体或多聚体蛋白,使用物理或自动组装成与天然病毒相似的空心颗粒作为疫苗,这被称为类病毒颗粒(VLP),如预防人乳头瘤病毒的HPV疫苗。目前通常使用酵母表达系统生产VLP疫苗,因为疫苗蛋白为胞内表达,完成发酵收集菌体后,需要将酵母细胞破碎,使用澄清过滤去除细胞碎片,经过Mustang膜层析捕获目标蛋白,宽泛流速范围,尖锐洗脱峰优势更加明显。进一步精纯后,超滤换液,进入制剂灌装环节。随着疫苗研制技术发展,上述提到的传统疫苗中的细菌多糖疫苗,为了提高其免疫效应,使用化学方法将蛋白成份与多糖结合,制备出多糖结合疫苗,可增加婴幼儿对细菌多糖的免疫效应。其工艺主要流程是上游经过细菌发酵,收集菌体,加入灭活剂进行脱毒处理后,使用深层过滤方法以保证过程的生物符合。使用超滤系统浓缩降低收获液体积并去除小分子蛋白,经过澄清过滤拦截大分子及有形杂质后,重复经过超滤和澄清过滤,完成多糖的制备。此时,可以进行多糖疫苗的制剂灌装。结合疫苗则进入蛋白结合步骤,此步骤主要使用化学方法将蛋白与多糖结合,过程中除了结合的目标产物外,还会产生游离多糖和蛋白,一般采用超滤和层析方法去除。在制剂灌装阶段使用一次性配液灌装系统,可以提高批件切换效率,避免不同血清型原液的交叉污染。多糖结合疫苗由于是通过化学方法将蛋白与多糖结合,因此需要对生产/加工后的大分子完整性进行监测。贝克曼库尔特的分析型超速离心技术(AUC)现在被认为是评估分子完整性和聚集体的重要技术,可以对蛋白质和细菌多糖组成的的大型糖缀合物分子量分布进行检测,从而分析多糖结合疫苗的完整性情况。病毒载体疫苗是一种利用病毒疫苗减毒株或非复制型病毒作为载体,将抗原基因的编码有效地传递到宿主细胞核并引发免疫应答的疫苗。目前已有多种病毒,如腺病毒、慢病毒、水疱性口炎病毒、疱疹病毒、麻疹病毒和重组牛痘病毒安卡拉株等作为载体用于疫苗的研发。病毒基因组可以表达任何特定的抗原,并可稳定接受大基因片段的插入,抗原可在宿主中准确的合成、修饰以及靶向特异细胞,使得病毒载体技术可用于多种疫苗开发。例如,康希诺生物的腺病毒载体新冠疫苗(Ad5-nCoV)是把新冠病毒S蛋白的基因构建到腺病毒基因组。外壳仍然是腺病毒的正常外壳蛋白,但里面的基因却含有编码新冠病毒S蛋白的基因。因此,腺病毒侵染宿主细胞的时候,把编码新冠病毒S蛋白的基因都释放到宿主细胞,在细胞质中合成S蛋白,由S蛋白激发一系列的免疫反应。
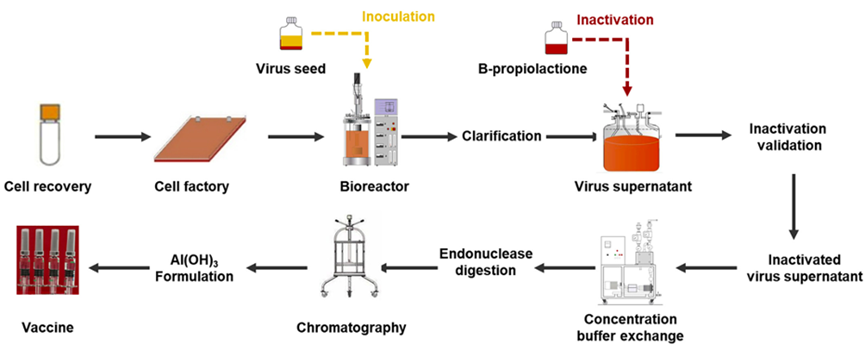
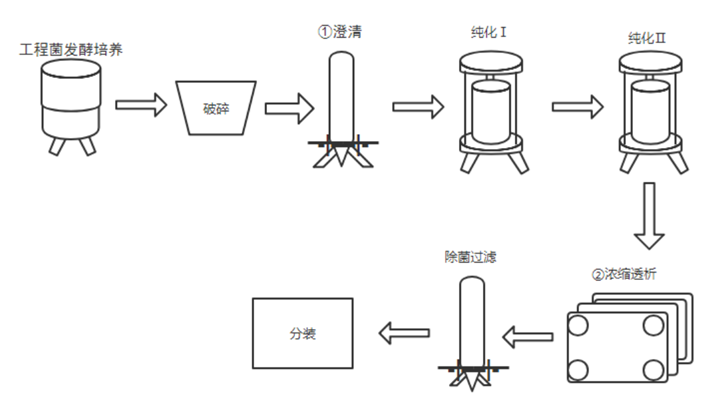
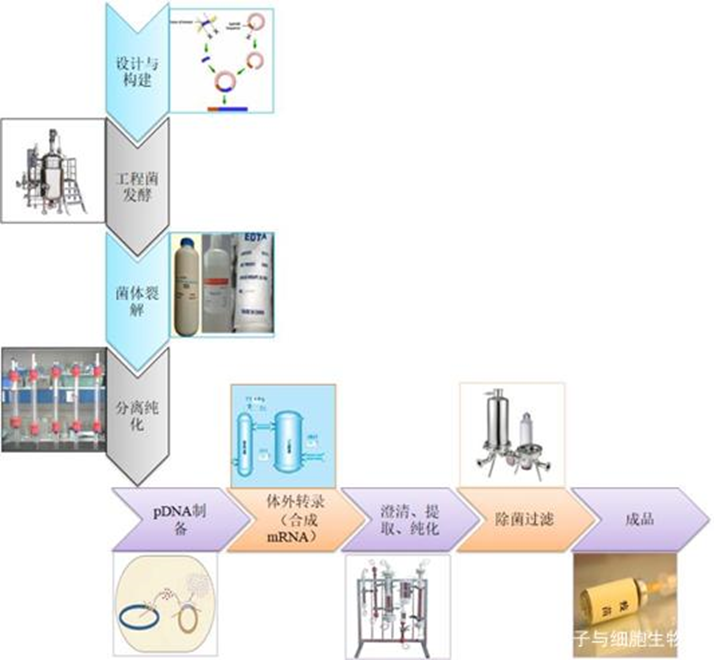
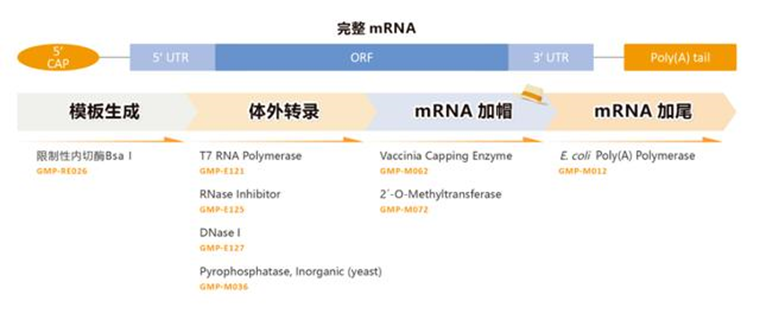
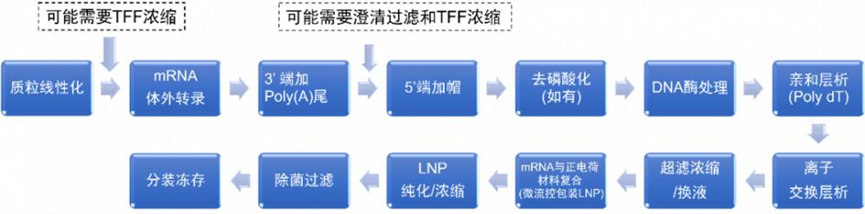
灭活疫苗是对病毒或细菌进行培养后通过物理或化学方法处理将其灭活从而获得无感染活性的一类疫苗。相较于减毒疫苗和基因工程疫苗,灭活疫苗具有研发周期短、制备工艺相对成熟、无感染毒力和安全性高等优点。但一般需要多次接种才能产生保护性免疫[2],通常诱导产生体液免疫应答,细胞免疫普遍较弱。目前已在国内上市的灭活疫苗包括脊灰灭活疫苗、乙脑灭活疫苗、百日咳-白喉-破伤风(百白破)疫苗、流感疫苗和人用狂犬病疫苗等,以及国药中生和科兴生物的新冠灭活疫苗。灭活疫苗平台相对成熟,安全性高,应对新发病原体响应速度快。它的生产工艺流程包括以下几个流程:1.病原体的培养:灭活疫苗的制作需要先培养病原体。病原体可以是病毒、细菌或其他微生物。在实验室中,病原体会被培养在适当的培养基上,以便它们能够生长和繁殖。2.病原体的灭活:一旦病原体被培养出来,就需要将其灭活。灭活的方法有多种,包括化学灭活、热灭活和辐射灭活等。这些方法都能够杀死病原体,但不会破坏其抗原性,从而使其仍能够激发人体免疫系统产生免疫反应。3.病原体的提取和纯化:灭活的病原体需要被提取和纯化,以便制成疫苗。这个过程通常涉及到多个步骤,包括离心、过滤、沉淀和洗涤等。这些步骤可以去除病原体中的杂质,从而提高疫苗的纯度和效力。4.疫苗的配制和包装:一旦病原体被提取和纯化,就需要将其配制成疫苗。这个过程通常涉及到将病原体与适当的辅料混合在一起,以便制成疫苗。这些辅料可以包括防腐剂、稳定剂和缓冲剂等。一.旦疫苗被配制好,就需要将其包装在适当的容器中,以便运输和储存。5.疫苗的质量控制:灭活疫苗需要经过质量控制,以确保其安全和有效。这个过程通常涉及到多个步骤,包括疫苗的理化性质测试、微生物学测试和动物实验等。只有通过了这些测试,疫苗才能够被批准用于人类接种。灭活疫苗的生产工艺流程是一个复 杂的过程,需要经过多个步骤才能够制成。这些步骤包括病原体的培养、灭活、提取和纯化、疫苗的配制和包装以及疫苗的质量控制等。只有通过这些步骤,才能够制成安全有效的灭活疫苗,用于预防疾病。DNA疫苗是将编码抗原蛋白的真核表达盒插入到细菌质粒中,再由高效的真核启动子驱动抗原蛋白的表达。DNA疫苗可以诱导机体产生体液免疫和细胞免疫、免疫效果持久性强、制备简单、易大规模生产,但也存在免疫原性弱、质粒DNA递送效率低和表达效率低等不足,以及外源基因整合到宿主基因组而导致的突变和生成肿瘤的风险。目前进入临床试验的DNA疫苗有中东呼吸综合征疫苗、寨卡病毒疫苗、HIV疫苗、流感疫苗、EBOV疫苗、宫颈癌疫苗GX-188E、B细胞淋巴瘤疫苗、登革热疫苗TVDV等,以及11个COVID-19疫苗,其中INO4800编码SARA-CoV-2全长S蛋白,Ⅰ期临床研究数据显示该疫苗无严重不良反应,能刺激产生体液免疫和细胞免疫。DNA疫苗受限于较弱的免疫应答和较大的免疫剂量,以及如何有效递送,期待未来改进。1.质粒库和三级种子库的建立:天然质粒存在缺陷,不能直接应用于实际基因工程。构建良好的质粒库和种子库,可以高效生产特定需求的质粒DNA疫苗。2.工程菌的发酵培养DNA:疫苗工程菌的发酵培养实际上是DNA疫苗生产工艺的重要步骤,培养菌的好坏会在很大程度上决定质粒产量。所以需要获得质量较高的菌群,优化培养方案。3.裂解菌体: DNA疫苗的生产,需要使用裂解工艺,这就需要进行裂解剂的选择、裂解工艺的优化研究,并进行工艺验证。在大规模生产中,不能采用实验室常用的超声破碎和高压匀浆以及碱裂解法等方法。我们需要控制温和稳定的反应体系,控制裂解时间在5分钟以内(时间也不宜过短),裂解pH值范围为12.0-12.5, 搅拌条件需温和且可以充分均匀。4.质粒DNA的回收:裂解处理完成后,需要对所得液体进行澄清处理。合适的澄清操作可以初步去除细胞碎片、全细胞、胶质及其他一些较大的聚集物,为下游后续的工艺减少压力。在一-定程度上,澄清还可以降低一些不溶性杂质、宿主细胞蛋白及核酸的含量。一般使用离心、过滤工艺实现该流程。有时可分为多个步骤,如先进行初步澄清除去较大杂质颗粒,再进行澄清除去胶质和较小颗粒。5.质粒初步纯化:进行裂解完的溶液通常还含有细胞蛋白(杂蛋白)、培养中引入的杂质等物质。如果疫苗中含杂质量过多,则会引起过敏反应或其他不良反应。因此,疫苗必须进行纯化,去除杂质。初步纯化可以滤去大部分杂质,降低后续工艺的压力。我们应通过对杂质去除率、DNA回收率等的研究选择不同截留分子量的超滤膜、确定浓缩倍数。组件的选择需要根据当次的生产所需(包括需要了解过程流体和CIP (溶出物、吸附、溶胀、脱落,通过VI级) 的化学和机械稳固性、进料通道填塞、残存/工作体积、传质效率等一系列的参数),按照过滤组件供应商所提供的数据选择,并且需要进行小规模试验后(组件需要能可靠线性放大),确定最终的生产工艺的所需组件规格与设定。-般性的工艺流程可如下(注:各操作条件可具有灵活性,实际根据产品规格要与生产工艺相适应,确保性能优良)。6.质粒高度纯化:纯化时,需要使电导率、紫外吸收、盐浓度、pH值均达到平衡,让条件温和稳定,一般凝 胶过滤层析配合其他层析方法联合使用达到最佳效果。柱层析和/或密度梯度离心为去除杂质的有效步骤,应优化层析条件,如层析柱类型、上样量、洗脱液条件等工艺参数。纯化工艺确定后,还要对其进行验证。通过对各纯化步骤对细胞基质相关杂质、工艺相关杂质(如有机溶剂、核酸内切酶、灭活剂、裂解剂等)的去除效果以及对有效成分的分离纯化效果的验证,来评估纯化工艺的合理性。同时,还要关注纯化过程中污染的控制,进行中间产物(如超滤液、层析洗脱液等)及微生物限度的检测,并根据多批次的生产检定结果建立限度标准。7.浓缩、配制、除菌过滤以及分装等:膜组件(超滤浓缩) :中空纤维膜组件,平板膜包等都可以满足基本浓缩工艺要求。完成浓缩后,再进行除菌过滤,确保产品的无污染,并根据要求进行配置分装。制备工艺是制备成功的关键因素,但是质粒库、种子库、工程菌发酵液、疫苗原液和成品的样品质量检测等质量控制体系与保证体系也是在DNA疫苗制备的非常关键的因素。以及对产品的毒性检测也是值得深入研究的。mRNA疫苗的研发过程包括选择目标病原体的特异性抗原蛋白,对该蛋白基因进行测序、合成并克隆到DNA模板质粒中,在体外转录成mRNA,然后接种到受试者体内。目前,mRNA疫苗主要包括两类,传统的非复制型mRNA和自我扩增型mRNA。相比于传统疫苗,mRNA疫苗具有与活病毒类似的免疫应答机制、无感染或整合到宿主基因组的风险、更稳定并能够高效表达抗原蛋白、简单快速的化学合成制备更容易低成本和大规模生产。目前研究较多的是自我扩增型RNA(SAM),因为其含有一个α病毒基因组,有完整的编码RNA复制机制的相关基因。以新冠病毒(SARS-CoV-2)mRNA疫苗为例,其生产工艺流程大致如下:1.DNA原液制备:首先需要设计与构建含有S蛋白基因序列的载体,然后通过大肠杆菌放大培养,获得大量的携带S蛋白基因序列的质粒。2.mRNA原液的制备:获取的携带S蛋白基因序列的质粒线性化{(噬菌体启动子(T7)-5 UTR-开放阅读框(ORF)-3 个非翻译区(UTR)-polyA}通过体外转录(IVT)将前mRNA5'端加帽子。后续需要经过一系列的纯化,除菌等过程。除去酶、游离核苷酸、残留 DNA 和外源 RNA 片段,dsRNA, 及反应体系中的免疫原性杂质。满足 GMP 生产的质量需求。Moderna的mRNA还需要把尿苷替换成假尿苷,以降低免疫原性。3.利用脂质微粒进行包封:制备递送系统,例如基于聚合物或脂质的纳米颗粒(LNP),然后使用不同制造商特有的方法将纯化的mRNA封装在其中。由此产生的mRNA/递送纳米颗粒组件经过浓缩、缓冲液交换和无菌过滤。然后最终评估并按此顺序包装成袋/瓶作为原料药。原料药通常在最终形成(尽管不适用于某些工艺)最终药物产品填充之前冷冻储存,在某些情况下随后还需要进行冻干。