腺相关病毒 (AAV) 是基因治疗中使用最广泛的传递机制,截至 2021 年,占基于病毒载体的基因治疗管线的 82%。几种基于 AAV 的疗法已获得批准:Glybera(脂蛋白脂肪酶缺乏症)、Luxturna(遗传性视网膜疾病)、Zolgensma(脊髓性肌萎缩症)、Upstaza(芳香族 L-氨基酸脱羧酶缺乏症)和最近的 Hemgenix(B 型血友病)。超过 200 种基于 AAV 的疗法正在开发中,预计到 2030 年 AAV 市场将增长 43%。
AAV 因其固有的极具吸引力的生物学特性而受到欢迎。AAV 是一种小型无囊膜病毒,可以通过长期转基因表达转导分裂细胞和非分裂细胞,提供广泛的治疗靶点。可用的各种 AAV 血清型还提供了特异性靶向所需组织的能力。安全性方面的另一个优势源于 AAV 无法独立复制。
最初于 1965 年在腺病毒样本中发现,AAV 是依赖细小病毒属的成员,需要辅助病毒感染才能复制。单链 DNA 基因组长度约为 4.7 kb,由两个基因侧翼的两个反向末端重复序列 (ITR) 组成。代表基因编码四种代表蛋白,有助于复制和包装病毒基因组。cap 基因编码结构蛋白 VP1、VP2 和 VP3,以及两种非结构蛋白:组装激活蛋白 (AAP) 和膜相关辅助蛋白 (MAAP) 。对于治疗性基因递送应用,重组 AAV (rAAV) 是通过用 ITR 之间所需的目的基因替换 rep 和 cap 基因来生成的。重组 AAV 有效载荷可以是单链或自我互补 DNA,其中基因组自我退火成双链配置,绕过转导后的第二链合成步骤。
已经开发了几种生产rAAV的方法:HEK293细胞的腺病毒感染、HEK293或BHK细胞的疱疹感染、Sf9细胞的杆状病毒感染以及HEK293细胞的瞬时转染。表达rep、cap和目的转基因的生产细胞系可以用野生型腺病毒感染。或者,幼仓鼠肾 (BHK) 细胞可以被两种重组单纯疱疹病毒 (rHSV) 感染,一种含有 rep 和 cap 基因,另一种含有转基因。第三种方法涉及用一种或多种含有所需基因的杆状病毒感染 Sf9 昆虫细胞。然而,生产 rAAV 最常见的选择是瞬时转染 HEK293 细胞。该策略于 1998 年首次被描述,利用含有腺病毒辅助基因、rep/cap 基因和目的转基因的质粒。与其它生产 rAAV 的方法相比,瞬时转染工艺具有快速启动初始开发的优势,但成本高昂且难以规模放大。
瞬时转染涉及一种化学试剂,将编码 rAAV 结构和合成基因的 DNA 递送至 HEK293 细胞中(图 1)。这些基因只是暂时表达,因为病毒和治疗基因没有整合到 HEK293 基因组中,并且每次生产运行都需要转染操作。在引入 DNA 之前,将细胞培养扩大到生产规模,通常在三个质粒上提供 DNA,其中辅助质粒、rep/cap 和转基因在单独的构建体上,尽管也有文章描述了二质粒系统。尽管质粒 DNA 通常是生物来源的,但修饰衣壳或质粒上的治疗性转基因比哺乳动物细胞系更简单。
本文将介绍开发和优化在悬浮 HEK293 细胞中生产 rAAV 的上游瞬时转染工艺的最新策略和挑战。尽管转染工艺最初是针对贴壁 HEK293 细胞开发的,但如今大多数工艺都是基于悬浮的,更适合大规模生产。四个主要领域(大致对应于该工艺的原材料)对 rAAV 的生产力和质量有显著影响:转染试剂、质粒、细胞培养基和细胞系。尽管策略可细分为这些类别,但它们之间存在相互作用和相互依赖。我们认识到,通过生物反应器工艺优化可以取得重大成果,而更大的挑战在于工艺放大,但上游转染工艺的这些方面在此不做详细讨论。
转染试剂
转染过程取决于以有效方式将质粒 DNA 递送至细胞的能力。机械递送方法(例如电转)已经开发出来,但它们通常需要额外的设备和进一步的工艺步骤(例如缓冲液置换)。相反,化学递送方法是通过瞬时转染生产 AAV 的主要选择。早期技术利用磷酸钙沉淀。然而,该方法需要精确的 pH 控制以获得最佳转染效率,以及转染后的培养基置换以抵消试剂的细胞毒性。随着向基于悬浮的工艺的转变,使得细胞培养操作变得更加可放大,磷酸钙被取代。在过去的几十年里,人们开发出了多种更适合生产的试剂,它们依赖于阳离子试剂和阴离子 DNA 之间的相互作用来进入细胞。这些包括阳离子聚合物(例如聚乙烯亚胺)、阳离子脂质基试剂(例如 Lipofectamine)和其它阳离子物质(例如 FectoVIR)。
无论使用哪种试剂,转染过程通常涉及将试剂和 DNA 混合,然后进行试剂-DNA 复合物形成的孵育期,然后添加到培养物中。该工艺过程的细节由试剂决定,并且经常需根据经验进行优化。
阳离子聚合物聚乙烯亚胺 (PEI) 是最早用于在悬浮驯化的 HEK293 细胞中生产 AAV 的转染试剂之一,并且至今仍在常规使用。经常使用多种 PEI,因为该试剂有多种分子量的支链或直链形式。一种常见的选择是 PEI MAX,一种来自 Polysciences 的 40 kDa 线性 PEI 。最近发现,与 PEI MAX 相比,PEIpro (Polyplus-transfection) 和 PEI Prime (Serochem) 产生的 AAV 载体基因组滴度略高。
由于 PEI 是一种广泛使用的转染试剂,因此对其络合和递送机制进行了研究,并报道了许多围绕 PEI 转染过程的优化。PEI 将 DNA 凝结成带正电荷的复合物,然后通过疏水相互作用聚集。通过内吞作用进入细胞后,PEI-DNA 复合物逃离内体。虽然确切的机制尚不清楚,但 PEI 被认为可以促进解复合的 DNA 进入细胞核。
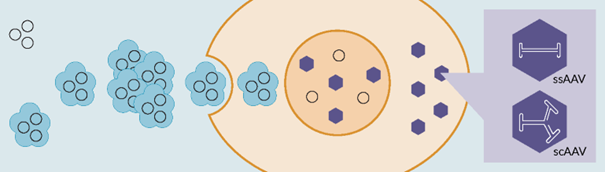
图1 瞬时转染。质粒DNA(黑色圆圈)和转染试剂(蓝色)形成复合物,通过内吞作用进入细胞。AAV 衣壳组装和病毒基因组在细胞核中包装后,病毒颗粒(紫色)被分泌到细胞质中。有效载荷可以设计为 ssDNA 或 scDNA 基因组。
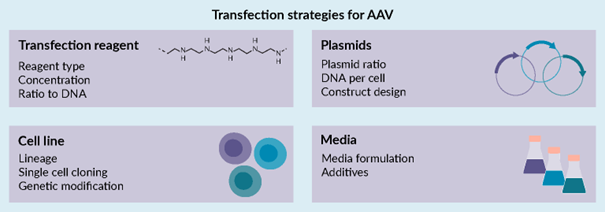
图 2 通过瞬时转染生产 AAV 的策略总结。
虽然 PEI 价格实惠且作为转染试剂已得到广泛认可,但 PEI-DNA 络合的性质在更大范围内提出了挑战。因此,除了提高载体生产力外,最近的试剂开发还集中在转染可放大性上。2020年,Polyplus-transfection发布了新型转染试剂FectoVIR-AAV,该试剂是为提高载体生产力和可放大性而开发的。Polyplus 的转染研究证明,与 PEI MAX 相比,使用 FectoVIR-AAV 的 AAV2 感染滴度增加了十倍,其它人报告,与 PEIpro 和未指明的市场替代品相比,使用 FectoVIR-AAV 的病毒基因组滴度增加了。此外,发现 FectoVIR-AAV-DNA 复合物可保持稳定长达 6 小时,并且可以浓缩 10 倍,仅占最终培养工作体积的 1%,而不影响载体基因组滴度。较长的孵化时间和较小的体积具有简化大规模 AAV 生产工艺的优势。
阳离子脂质试剂(例如 Lipofectamine)也已用于瞬时转染。Shi等人报道,用 Lipofectamine 3000 转染的 HEK293 细胞的转染效率接近 100%。另一种市售转染试剂是 AAV MAX,据报道,与 PEI MAX 和 PEIpro 相比,其病毒基因组滴度增加了五倍。其它转染试剂,例如 TransIT-VirusGen,包括阳离子脂质和聚合物。与其它类别的转染试剂一样,脂质试剂还有很大的优化空间。最近,Guan等人合成的阳离子脂质体与 PEI MAX 相比,AAV 生产率显著提高。建议优化脂质体的大小,以进一步提高转染效率。
有几个因素影响 PEI-DNA 复合物的稳定性,包括 PEI 与 DNA 的比例。研究发现较高量的 PEI 可以稳定复合物,但也与更大的细胞聚集和细胞毒性有关。因此,许多方案使用范围为 2:1–4:1 的 PEI:DNA 比例。添加盐(例如 NaCl)也被证明可以提高稳定性。此外,PEI-DNA 复合物的尺寸随着时间的推移而增加,直径达到 3 µm 或更大。因此,许多转染方案仅将 PEI-DNA 溶液孵育 10-15 分钟,然后将其添加到细胞培养液中。由于较短的孵育时间使大规模生产变得复杂,因此已经提出了几种控制 PEI-DNA 络合的方法。这些措施包括添加表面活性剂、降低 pH 值或温度或使用粘性共溶剂。Hu等人开发了一种通过调节一系列受限冲击喷射混合器中的 pH 值和盐浓度来停止不同粒径的 PEI-DNA 络合的方法。与标准方案相比,该技术在 2 L 规模下可产生更高的慢病毒载体感染滴度。此外,PEI-DNA 复合物在室温下表现出可稳定两天,在 -80°C 下表现出四个月的稳定性,为生产提供了灵活性。
最近,开发了三质粒转染工艺的机制模型,描述了质粒递送和 rAAV 生物合成的动力学。模型实验和验证实验都发现了质粒 DNA 进入细胞核的瓶颈,以及单链 DNA 和衣壳合成的时机不正确,导致大量的空衣壳。成功靶向细胞核的转染试剂的开发将显著提高 rAAV 的生产率。
自从采用转染技术生产 AAV 以来,PEI 和替代试剂的许多改进已经被开发出来。试剂选择和络合优化是提高生产率和可生产性的策略。然而,试剂仍然限制转染效率,并且必须在影响转染的其它变量的背景下考虑试剂和络合条件,如下文部分所述。
质粒
质粒 DNA 是转染工艺的另一个关键组成部分。由于 rAAV 生物合成是在三个独立的构建体上提供的,因此发现质粒总量以及相对质粒比例可以调节 rAAV 生产力和质量。质粒 DNA 的数量也与转染时的细胞密度有关。已经进行了大量研究来优化用于 rAAV 生产的细胞密度、DNA 量和质粒比例。
DNA与质粒比例
据报道,总质粒 DNA 量约为每 10^6 cells 1.5 µg。研究发现,较高数量的 DNA 并没有提高滴度。此外,质粒DNA占生产成本的很大一部分。还有研究探索了每种质粒对感染滴度的影响 - 一项表征质粒比例的早期研究使用非编码“填充”质粒来独立改变三个 rAAV 质粒的数量。发现等摩尔比例的辅助质粒、rep/cap 和转基因质粒可产生最高的感染滴度。将rep/cap和转基因质粒的量各减少至10%,同时将辅助质粒的量维持在80%,导致感染滴度仅降低33%。然而,将辅助质粒减少至 30% 会导致感染滴度降低十倍以上。这凸显了辅助基因在载体生产中的重要性。此外,还发现减少rep/cap量会降低感染滴度。当使用质粒比例来优化rAAV生产力时,发现较高比例的辅助质粒和rep/cap质粒增加了载体基因组滴度,报告最佳辅助:rep/cap:转基因摩尔比为2:1.5:1。
原文:A.Bretti, S.Doong, AAV production by transient transfection: strategies & challenges. Cell & Gene Therapy Insights 2023; 9(5), 763–776.






