来源:远方基金
新药研发是医药公司运转的齿轮,推动公司发展,是一项投资高、风险高、周期长,竞争激烈,但利润率高的工程。10年时间,花费10亿美元,研发一款新药,无论是利益的驱动,还是拯救万千患者的成就感,药企的这一行为都值得我们尊敬。
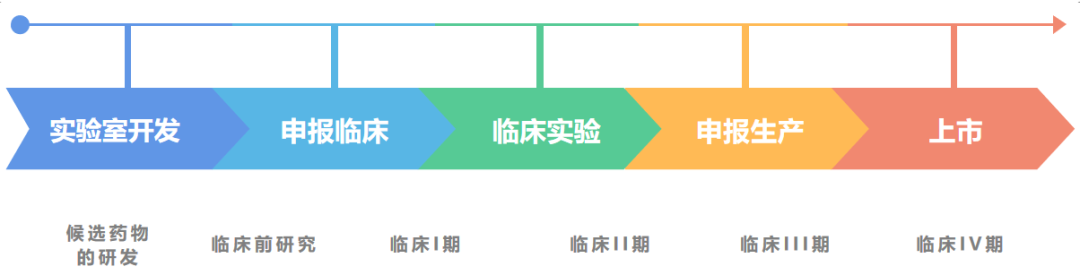
一款新药从研发到上市,都要经历那些过程呢?本文以小分子药物为例,大致梳理整个流程。
新药的研发分为两个阶段:研究和开发。这两个阶段是相继发生有互相联系的。区分两个阶段的标志是候选药物的确定,即在确定候选药物之前为研究阶段,确定之后的工作为开发阶段。所谓候选药物是指拟进行系统的临床前试验并进入临床研究的活性化合物。
一
新药研究阶段
研究阶段包括四个重要环节,即药物作用靶点(target)以及生物标记(biomarker)的选择与确认、先导化合物(lead compound)的确定、构效关系的研究与活性化合物的筛选、候选药物(candidate)的确定。
1、药物作用靶点(target)以及生物标记(biomarker)的选择与确认
早期人们对药物作用靶标认识有限,往往只知道有效,但不知如何起效。比如,百年来,人们知道阿司匹林(aspirin)具有解热、消炎、止痛、抗血栓,甚至抗癌作用。直到1971年,英国人John R. Vane 在《Nature》期刊发文才阐明了Aspirin作用机理为抑制前列腺素合成,并于1982荣获Nobel生理和医学奖。现代生物医学的研究进展,以及人类基因图谱的建立,让人类对疾病的机理了解更加准确,为新药开发提供了明确的方向、具体的靶标。
一般而言,药物作用的新靶点一旦被发现,往往会成为一系列新药发现的突破口。通俗易懂一点解释,如果把病比作一把锁,那么靶点为锁芯,如若找到锁芯,研究出锁芯的立体结构,那么我们就可以根据它的立体结构为其配备一把专有的钥匙,那么该新药即为这把专有的钥匙。
2、先导化合物(lead compound)的确定
一旦选定了药物作用的靶标,药物化学家(medicinal chemist)首先要找到一个对该靶标有作用的化合物。这个化合物可以来自天然产物(动物、植物、海洋生物);也可以是根据靶标的空间结构,计算机模拟设计、合成的化合物;还可以根据文献报道或以前其它项目的研究发现。比如,某一类化合物具有作用于该靶标的药理活性或副反应等等。目前我们常用的方法是跟踪国外研发机构对某一靶标的药物开发,以他们的化合物作为先导,希望设计出更优秀的化合物。
3、构效关系的研究与活性化合物的筛选
围绕先导化合物,设计并合成大量新化合物,通过对所合成化合物活性数据与化合物结构的构效关系分析,进一步有效的指导后续的化合物结构优化和修饰,以期得到活性更好的化合物。
4、候选药物(candidate)的确定
候选药物的确定标志着分子设计、化学合成、生物评价循环反馈的完成,达到了新药开发的标准。候选药物的确定也没有统一的标准,每个项目选择的候选药物数量也不尽相同,总的趋势是要求候选药物具有较好的成药性,为了降低研发失败的概率、缩短开发时间,候选药物的选定一般要遵循以下原则。
图表:候选药物的确定遵循的一般原则

资料来源:药物化学总论,中金公司研究部
二
新药开发阶段
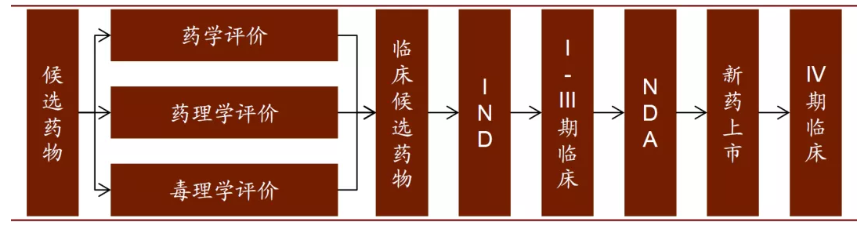
候选药物确定后,新药研发就进入开发阶段,开发阶段主要分为以下五个环节:临床前实验、临床研究、新药申请、批准上市、上市后检测。
图表:新药临床开发过程
资料来源:CNKI,中金公司研究部
1、临床前实验
(1)化学、制造和控制(Chemical Manufacture and Control, CMC)
新药开发工作的第一步是原料药合成工艺研发(Process R & D),这是一个不断改进、完善的过程。第一批提供的原料药主要用于毒理研究(100—1000g),要求是越快越好,成本不是主要考虑因素。因此,只要药化路线能够实现毒理批合成,工艺研发部门就会采用。但随着项目的推进,工艺部门会根据需要设计全新合成路线,开发合理生产工艺来满足从I—III期临床用药与商业化的需求;同理,制剂部门首先也会以最简单的形式给药,完成毒理研究,然后不断完成处方工艺研究,开发出商业化的制剂工艺。
(2)药代动力学(Pharmacokinetics, PK)
了解药物在动物体内的吸收、分布、代谢、排泄(ADME),这些数据可以指导临床研究以何种形式给药(口服、吸入、针剂),给药频率与剂量。
(3)安全性药理(Safety Pharmacology)
证明该化合物针对特定目标疾病具有生物活性,同时评估药物对疗效以外的作用,比如可能的副作用,尤其是对心血管、呼吸、中枢神经系统的影响。
(4)毒理研究(Toxicology)
毒理研究种类较多,包括急性毒性、亚急性毒性、慢性毒性、生殖毒性、致癌性、致突变性等。为了加速新药能及早验证是否有疗效,尤其是对一些抗癌药,有些耗时费钱的毒理实验(如致癌性、生殖毒性)是可容许在临床试验阶段再进行。
(5)制剂开发
制剂开发是药物研发的一个重要环节。早期制剂研究并不需要完整的处方开发,所有研究围绕毒理学研究和一期临床时方便给药即可,目的是将候选药物尽快推向临床。随着项目推进,给药方式和处方研究就越来越全面。比如,有的药胃肠吸收很差,就需要开发为注射剂。有的药对在胃酸里面会失去活性,就需要开发为肠溶制剂。有的化合物溶解性不好,也可以通过制剂来部分解决这个问题。
前面这些内容都统称为临床前研究,是药物开发的第一阶段。临床前各个实验的步骤可不是严格按照上述这个顺序展开,而是一个相互包容、相互协调的关系。比如,原料药工艺研发部门,完成毒理批样品合成后,就必须立即开展合成路线的选择,开发新的合成工艺,提供足够量的原料药以满足制剂部门制剂研究用原料药和9-12个月后开展I期临床用药的需求。
2、临床研究(Clinical studies)
Ⅰ期临床试验
在新药开发过程中,将新药第一次用于人体以研究新药的性质的试验,称之为Ⅰ期临床试验。这一阶段的临床试验一般需要征集20-100名正常和健康的志愿者(对肿瘤药物而言通常为肿瘤病人,但人数更少),在严格控制的条件下,给不同剂量(随着对新药的安全性了解的增加,给药的剂量也逐渐提高,并可以多剂量给药)的药物试验于健康志愿者,住院以进行24小时的密切监护,仔细监测药物的血液浓度、排泄性质和任何有益反应或不良作用,以评价药物在人体内的性质。同时也要通过这一阶段的临床试验获得其吸收、分布、代谢和排泄以及药效持续时间的数据和资料;以及药物最高和最低剂量的信息,以便确定将来在病人身上使用的合适剂量。可见,Ⅰ期临床试验是初步的临床药理学及人体安全性评价试验,目的在于观测人体对新药的耐受程度和药代动力学,为制定给药方案和安全剂量提供依据。
Ⅱ期临床试验
为了证实药品的治疗作用的,就必须在真正的病人身上进行临床研究,即Ⅱ期临床试验。Ⅱ期的临床试验通常需要征集100-500名相关病人进行试验。其主要目的是获得药物治疗有效性资料。
将试验新药给一定数量的病人志愿者,评价药物的药代动力学和排泄情况。这是因为药物在患病状态的人体内的作用方式与健康志愿者是不同的,对那些影响肠、胃、肝、和肾的药物尤其如此。Ⅱ期临床试验一般通过随机盲法对照试验(根据具体目的也可以采取其他设计形式),对新药的有效性和安全性作出初步评价,并为设计Ⅲ期临床试验和确定给药剂量方案提供依据。
Ⅲ期临床试验
当一个新药推进到三期临床,原料药和制剂工艺研究也推进到了相应的阶段。三期临床用药以商业化生产工艺提供临床用药。一般来讲,商业化生产的原料药生产工艺应该考虑以下因素:产品质量,生产安全性,生产成本,环境影响,生产的稳定性和可持续性。
Ⅲ期的临床试验通常需1000-5000名临床和住院病人,在医生的严格监控下,进一步获得该药物的有效性资料和鉴定副作用,以及与其他药物的相互作用关系。该阶段试验一般将对试验药物和安慰剂(不含活性物质)或已上市药品的有关参数进行对照和双盲法试验(医生和病人都不知道自己吃的是新药、老药或安慰剂),在更大范围的病人志愿者身上,进行扩大的多中心临床试验。最后,根据严格统计学数据分析,进一步评价药物的有效性和耐受性(或安全性),决定新药是否优于(superior)或不差于(not inferior)市场现有的“老药”。Ⅲ期临床试验是治疗作用的确证阶段,也是为药品注册申请获得批准提供依据的关键阶段,该阶段是临床研究项目的最繁忙和任务最集中的部分,无疑是整个临床试验中最重要的一步。三期临床研究往往持续好几年。
除了对成年病人研究外,还要特别研究药物对老年病人,有时还要包括儿童的安全性。一般来讲,老年病人和危重病人所要求的剂量要低一些,因为他们的身体不能有效地清除药物,使得他们对不良反应的耐受性更差,所以应当进行特别的研究来确定剂量。而儿童人群具有突变敏感性、迟发毒性和不同的药物代谢动力学性质等特点,因此在决定药物应用于儿童人群时,权衡疗效和药物不良反应应当是一个需要特别关注的问题。在国外,儿童参加的临床试验一般放在成人试验的Ⅲ期临床后才开始。如果一种疾病主要发生在儿童,并且很严重又没有其他治疗方法,美国食品与药品管理局允许Ⅰ期临床试验真接从儿童开始,即在不存在成人数据参照的情况下,允许从儿童开始药理评价。我国对此尚无明确规定。
上述任何一步反馈得到的结果不好,都有可能让一个候选药物胎死腹中。最悲惨的结果可能是这个项目就直接被取消了。2007年,Merck有四个三期临床药物失败。
能够通过全部3期临床评价而上市的新药越来越少,部分原因是开发出比市场上现有药物综合评价更好的新药越来越难。而一个药物从源头研发到3期临床是一个耗资巨大的过程。公开数据表明,平均下来一个新药要花费约为十亿美金(1 billion US dollars)。正是因为药物研发的耗资巨大,大公司花不起那么多钱同时展开多个项目研究,小公司又没有那么多的财力完成药物研发的全部流程。现在的药物研发的一个趋势是,小公司反而能够更好的找准市场上的空缺,开发出在临床前研究阶段具有良好表现的候选药物。这时大公司通过并购小公司或者购买专利(或者使用权),将这个项目买过来继续开发。如果是购买专利的情况,则会根据这个项目最后能够进展到哪个阶段,完成后相应得再支付给小公司一笔“奖金”,叫做milestone。
3、新药申请(New drug application, NDA)
4、批准上市
5、IV期临床研究(药物上市后监测)
中国和美国在新药研发相关流程上的不同之处

三
投资思路
(1)市场空间大
2017-2019年全球销售前十的药物包括了阿达木单抗、英夫利昔单抗、依那西普等自身免疫病用药和帕博利珠单抗、纳武利尤单抗、曲妥珠单抗、贝伐珠单抗、利妥昔单抗、来那度胺、伊布替尼等抗肿瘤药(个别已经退出2019年前十大榜单),这两个领域是大品种层出不穷的领域,市场空间和潜力均极大。
(2)大量市场需求未被满足
目前来看大多癌症种类依然是无法被彻底治愈的,目前抗肿瘤治疗的核心思路还是延长生存期、提升生存质量,因此在各个细分领域都有持续性的推出新的突破性疗法的潜力,不断的延长生存期,提高ORR(客观缓解率);同时由于中国和欧美国家的疾病图谱有所差异(如中国发病率较高的消化道类癌症在海外发病率较低),在某些领域中国未满足的临床需求是国产药企的重要机遇(如胃癌等)。
(3)放量速度快
心血管等慢性病领域用药放量速度慢,最有代表性的是信立泰的阿利沙坦酯和天士力的普佑克,上市四五年才一两亿的收入;而反观中国生物制药的安罗替尼,因为满足了国内对非小细胞肺癌三线疗法的需求,上市首日1.3亿元销售,2018年6-7亿,2019年直奔30亿了,这速度可想而知。






