灌流系统的稳健放大需要所有规模的可比条件,以确保同等的细胞培养性能。当连续工艺中的细胞在生物反应器外部循环时,如果射流和搅拌导致灌流进样和返回之间直接连接,则可能会出现性能损失。计算流体动力学可用于识别此类短路流、评估混合效率并最终调整灌流设置。本研究调查了从 2 L 玻璃生物反应器到 100 L 和 500 L 一次性中试规模系统的规模放大。高分辨率的格子玻尔兹曼大涡(Lattice Boltzmann Large Eddy)模拟在单相中进行,混合效率 (Emix) 进一步在 2 L 系统中进行了实验验证。该评估可以深入了解生物反应器内的流动模式、混合行为和细胞停留时间的信息。由于在所有测试条件下 Emix 均大于 90%,因此中试规模系统无需进行几何调整。在 2 L 规模下评估了两种不同的设置,其中流动方向发生变化,混合效率相差 10%。尽管如此,由于确认 2 L 设置的 Emix 也 >90%,并且所有规模的确定混合时间都在相似的范围内,因此 2 L 系统被认为是合适的缩小模型。结果证明了计算流体动力学模型如何用于生物制药行业强化生产过程的合理工艺设计。
人口的快速增长、疾病患病率的增加以及生物制药知识和接受度的不断提高迫使生物制药公司优化工艺。特别是过去几年对单克隆抗体(mAb)的需求有所增加。大多数单克隆抗体在中国仓鼠卵巢 (CHO) 细胞中生产,并采用补料分批工艺作为首选工艺策略。然而,对更高产品产量的需求鼓励了强化工艺策略的开发。因此,灌流工艺已成为即将推出的、利用细胞截留来提供更高细胞密度的生产技术的重要组成部分。最常见的技术,如切向流过滤 (TFF) 或交替式切向流 (ATF) 系统,都涉及中空纤维,用于将细胞绕回到生物反应器中,同时不断置换培养基。作为 N 阶段灌流或传统补料分批工艺的替代方案,生产力较低的生长阶段也可以转移到前阶段,从而在 N 阶段实现更高的单位体积生产力。通过这种强化补料分批策略,与低密度种子培养相比,滴度几乎翻倍。
不利的一面是,灌流模式也面临着挑战。除了技术复杂的设置增加了污染风险之外,高细胞密度还导致生物反应器中的粘度升高,从而降低混合效率。此外,喷射流和搅拌的组合可能会引起灌流进样和回流液流之间的直接连接,从而导致短路流的形成。因此,混合在高细胞密度培养中非常重要。混合不良的反应器会导致细胞环境中的局部异质性,例如底物浓度、pH、DO 和 CO2 梯度。因此,生物反应器的整体性能可能会因极端 pH 值、DO 或底物浓度供应不足而导致细胞活性下降,进而受到损害。其后果是产品滴度降低以及产品质量超出规格。
在过去的十年中,计算流体动力学 (CFD) 已用于生物制药环境中的多种应用或混合应用。示例性用例包括在微量滴定板中建立 kLa 模型、对冷冻容器中的热和质量传输(包括相变)进行建模以及优化UF/DF 工艺,包括混合效率评估。 Radoniqi 等人之前对 ATF 组件进行了数值流模拟。然而,他们的研究重点是中空纤维的内腔和膜污染的阐明,而不是罐内的混合性能。
一般来说,如果需要瞬态方法,传统的模拟方案在计算成本和时间方面可能非常昂贵。涉及格子玻尔兹曼大涡模拟 (LBLES) 的有前途的模拟方法在图形处理单元 (GPU) 上并行时可加速高分辨率瞬态模拟。它们对于混合研究的有效性已在多项研究中得到证明。与以数值方式近似求解宏观纳维-斯托克斯(Navier-Stokes)和能量方程的传统 CFD 方法不同,格子玻尔兹曼方法 (LBM) 在介观尺度上描述流域中的粒子行为。基于 LBM 的 CFD 工具(例如 M-Star)可对格子玻尔兹曼方程 (LBE) 进行数值求解。因此,所有必要的宏观流动变量都可以通过使用粒子分布函数和守恒定律来计算,以恢复宏观方程,例如纳维-斯托克斯方程。与其它方法相比,LBM 方法更适合具有复杂边界的模拟。除此之外,LBM 方法运行速度更快,因为 LBE 可以通过仅考虑线性流和碰撞过程来计算,而不是构造宏观连续方程,其中发生高阶计算。因此,这种方法特别适合描述连续灌流过程中存在的复杂混合现象的瞬态行为。
在这项工作中,目的是表征不同规模的灌流生物反应器的混合性能,以降低工艺失败的风险。最初,对 2 L 规模缩小灌流反应器进行了实验研究。获得的实验数据随后用于验证从格子玻尔兹曼方法 (LBM) CFD 模拟中检索到的混合效率。此外,还对100 L和500 L中试规模进行了模拟研究。除了混合效率外,还确定了流动模式和细胞停留时间,支持对不同规模的灌流系统的评估。
详细实验操作和结果,请参考原文。
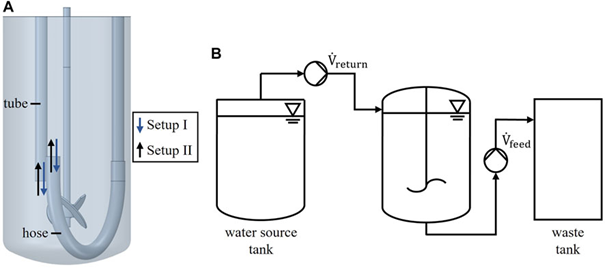
图 1. 反应器装置 (A),实验装置示意图 (B)。
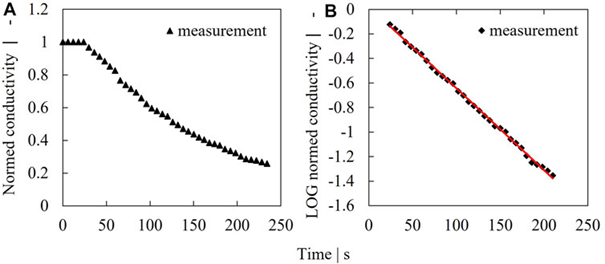
图 2. 稀释率测定示例。叶轮速度为 250 rpm 时测得的电导率信号 (A),对数浓度 (B)。
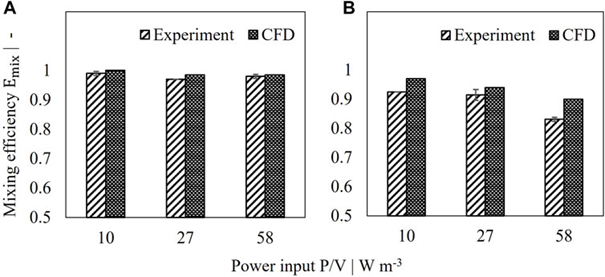
图 3. 2 L 灌流罐的模拟和测量混合效率比较。 (A) 设置 I,(B) 设置 II。
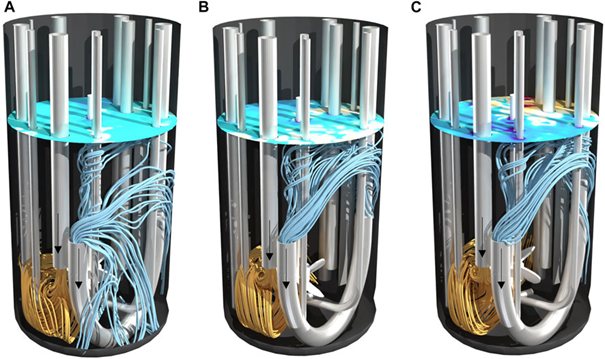
图 4. 设置 I 的 2 L 生物反应器在不同功率输入 (A) 10 W/m3、(B) 27 W/m3 和 (C) 58 W/m3 下的流线。以橙色向前计算的流线为流入,以蓝色向后计算的流线为流出。表面颜色表示涡流的拓扑结构。
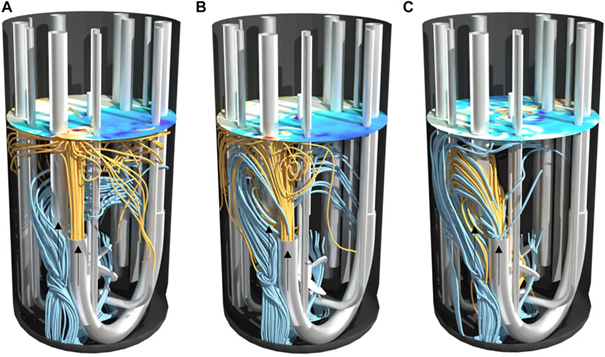
图 5. 设置 II 的 2 L 生物反应器在不同功率输入 (A) 10 W/m3、(B) 27 W/m3 和 (C) 58 W/m3 下的流线。以橙色向前计算的流线为流入,以蓝色向后计算的流线为流出。表面颜色表示涡流的拓扑结构。
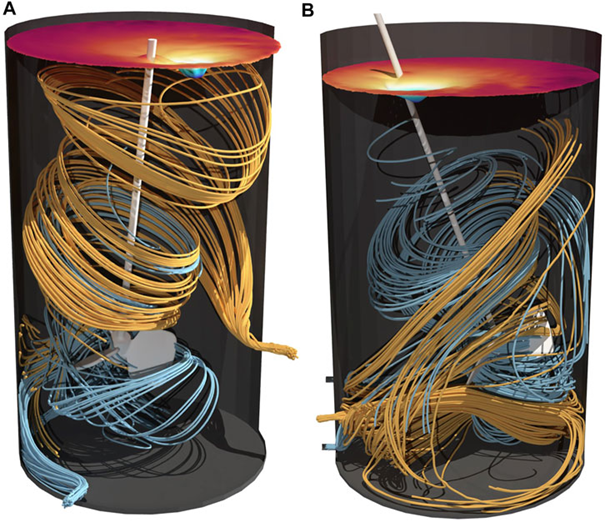
图 6. 100 L (A) 和 500 L (B) 灌流生物反应器中的流线。以橙色向前计算的流线为流入,以蓝色向后计算的流线为流出。表面颜色表示涡流的拓扑结构。
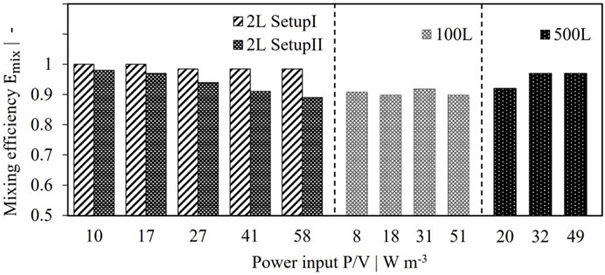
图 7. 2 L、100 L 和 500 L 灌流系统的混合效率比较。
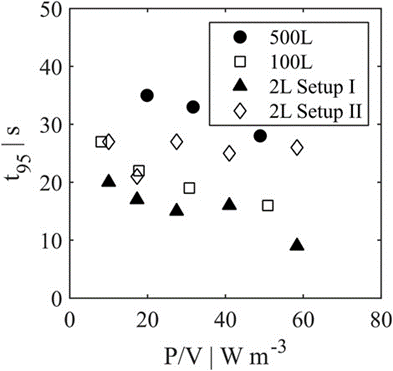
图 8. 2 L、100 L 和 500 L 灌流系统的混合时间 t95 比较。
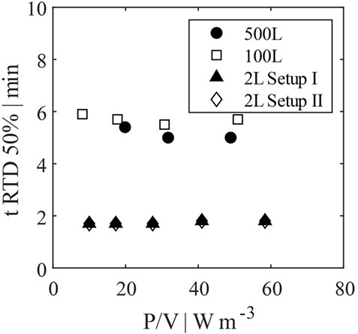
图 9. 2 L、100 L 和 500 L 灌流系统的停留时间分布比较。
总结
确定混合效率和防止短路流动是灌流系统表征和优化的重要组成部分。为了确保稳健的工艺性能,此类标准应在不同规模之间保持不变。格子玻尔兹曼大涡模拟已被证明是能够进行高分辨率瞬态模拟的有价值的工具。本研究展示了通过 LBLES 评估混合效率及其在 2 L 实验室规模灌流反应器中的验证。模拟与实验之间的差异低于 5%,但两种反应器设置和多个功率输入的差异为 8%。
通过模拟灌流反应器中细胞的流动模式、混合效率、混合时间和停留时间分布,研究了放大到 100 L 和 500 L 中试规模的情况。在所有情况下,混合效率均达到>90%。因此,不需要对反应器系统进行几何改造。考虑到检查的标准,2 L 系统被证明是适合中试规模灌流的规模缩小模型。设置 II 的结果稍微更好地匹配中试规模性能,但是,两个实验室规模反应器设置的差异被认为是不重要的。总之,建议在放大灌流工艺中采用这种 LBLES 方法作为风险缓解措施,以防止短路流导致的工艺失败。由于本研究仅包括单相模拟,因此未来的工作应重点关注多相系统。如果考虑气相,流动模式会有所不同,可能会导致混合时间和效率的改变。最终,所有模拟结果都必须通过细胞培养来证实。
原文:M.Kuschel, J.Wutz, M.Salli, et al., CFD supported scale up of perfusion bioreactors in biopharma. Front. Chem. Eng., 2023.






