腺相关病毒:简史
腺相关病毒 (Adeno-associated virus, AAV) 是一种无囊膜的T=1二十面体病毒,属于细小病毒科依赖病毒属。所有细小病毒都具有线性单链DNA基因组,两侧是作为DNA合成起点的反向末端重复序列 (ITR)。AAV基因组编码两个主要的基因“盒”,由三个启动子调控:p5和p19调控编码非结构蛋白的rep基因的表达,p40调控编码结构病毒颗粒蛋白 (VP1、VP2和VP3) 的cap基因的表达。rep和cap转录本都利用一个共同的多聚腺苷化信号。其它基因产物也被描述为由其它开放阅读框编码,例如装配激活蛋白 (AAP)。独特的是,AAV需要与“辅助”病毒 (如腺病毒(AdV) 或单纯疱疹病毒(HSV)) 共同感染才能生产性感染。
AAV最早是在20世纪60年代通过电子显微镜发现的,是腺病毒制剂中的污染物。随后的研究表明,与AAV血清学相关的病毒在人类中广泛传播。在没有辅助病毒的情况下的感染还没有记录,同时感染 (如AAV和Ad) 引起的疾病并不比单独感染Ad更严重,因此AAV被认为是非致病性的。
由于AAV在病原学上不被认为是病原体,因此AAV的研究活动最初仅限于少数实验室。AAV遗传的流线型特性,以紧凑、最小的病毒基因组为特征,促进了分子遗传分析,并为研究细胞途径和病毒-细胞相互作用提供了一个多功能平台。Muzyczka实验室的突破性研究表明,病毒基因可以被非病毒基因取代,例如报告基因或仅保留非编码ITR序列的治疗基因。这些初步报告表明,这种重组AAV结构可以作为基因递送载体,能够“转导”分裂细胞和非分裂细胞 (即转基因基因表达)。这些发现激发了人们对AAV基因治疗应用的兴趣。
将病毒基因组整合到宿主细胞基因组中并不是细小病毒复制的必然步骤,这对于一些已适合用作基因载体的其它病毒组而言是必需的,即逆转录病毒(逆转录病毒科)。然而,野生型 (wt) 或重组 AAV 的病毒颗粒 DNA 可能通过细胞介导的过程进行整合:wtAAV 有整合到 AAVS1 中的倾向,AAVS1 是人类 19 号染色体上的一个确定位点,而缺乏rep基因产物的重组AAV的整合是随机发生的,并且在基因组位置方面既罕见又相对不加区别。然而,有报道称病毒载体整合位点偏向载体和染色体 DNA 之间的(微观)同源区域,并且 AAV ITR 和 AAVS1 的序列相似性可能导致整合出现偏差。
AAV-5 的发现、分离和流行病学
目前,三种天然存在的 AAV 正在开发用于大多数基因治疗应用:AAV-2、AAV-5 和 AAV-9。分配给这些 AAV 分离株的数字名称有历史依据:继 1965 年首次发现 AAV 之后,从细胞培养制剂、组织样本和圈养猕猴中获得了具有不同抗原特性的其它 AAV 分离株。为了区分这些抗原性不同的 AAV,建立了基于血清学的命名系统。该系统根据 AAV 的分离顺序为它们分配数字名称,称为“血清型”(迄今为止,至少已识别出 12 种自然存在的血清型)。然而,此后已确定 AAV-5 实际上代表一种独立的病毒物种,名为“哺乳动物依赖细小病毒 1”。另一方面,所有其它 AAV 分离株都是另一种 AAV 物种“灵长类依赖细小病毒 1”的变种。
AAV-5 是由 Ursula Bantel-Schaal 博士和 Harald zur Hausen 博士于 1984 年在德国海德堡的德国癌症研究中心(Deutsches Krebsforschungszentrum 或 DKFZ)发现的。该病毒是从生殖器软骨瘤标本中临床分离出来的,并显示在腺病毒共感染的情况下可以感染培养中的人类细胞。将一份受感染细胞培养上清液提供给美国国立卫生研究院 (NIH),Kotin 实验室成员对病毒基因组进行分子克隆和测序。 Chiorini 等人证明重组 rAAV-5 载体具有生物活性,因此可将 AAV-2 载体基因组“反壳化”到细胞中。由于每种病毒之间的基因组差异,特别是 (i) ITR 序列和 (ii) Rep 蛋白识别序列基序,这一发现是出乎意料的。虽然之前的 AAV 基因治疗载体仅限于 AAV-2 衣壳,但使用来自更远亲的分离血清型(包括 AAV-4 和 AAV-5)的衣壳创建载体的能力建立了不同 AAV 分离株的“可载体性”。这些结果是 AAV 载体学领域的基础性发现。
在非临床研究中,AAV-5 载体已证明可以有效转导各种组织类型,包括肺、肝、肌肉和脑组织。目前,两种利用AAV-5的基因治疗产品已获得监管部门的批准,分别是uniQure针对B型血友病开发的Hemgenix™(FDA批准)和BioMarin针对A型血友病开发的Roctavian™(EMA批准)。其它基于 AAV-5 的基因疗法也正在开发中,用于治疗其它遗传疾病,包括肌营养不良症、血友病和遗传性视网膜疾病。此外,研究正在进行中,以探索 AAV-5 载体向大脑递送治疗基因的潜力,目标是治疗帕金森病和阿尔茨海默病等神经系统疾病。
尽管rAAV在基因治疗中很受欢迎,但对人类AAV感染的自然生物学和流行病学的了解仍然非常有限。然而,基于血清学和基因测序的研究提供了明确的证据,表明灵长类依赖细小病毒1在人群中自然传播。相比之下,依赖细小病毒哺乳动物1(即AAV-5)在人类中自然循环的证据主要基于血清学数据。总体而言,AAV-5 特异性抗体的流行率似乎低于其它 AAV 血清型,并且不同人群之间似乎存在差异。
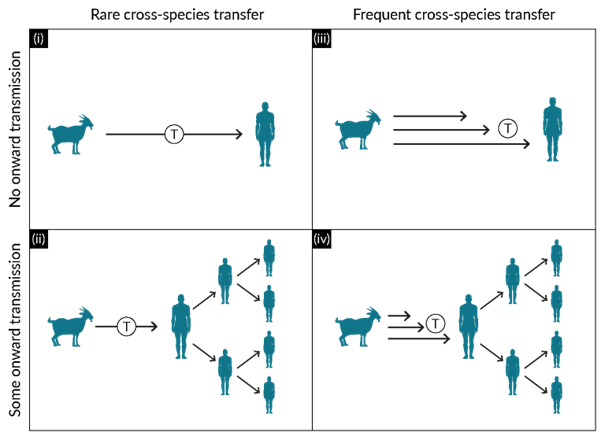
图1. 腺相关病毒的进化关系。自举系统发育树(1000 个重复)显示了腺相关病毒 (AAV) 分离株之间重建的进化关系。该树是根据跨越rep基因的393个核苷酸的比对构建的,使用RAxML中实现的最大似然和核苷酸替换的一般时间可逆模型。星号表示引导程序支持 >70% 的节点。比例尺表示每个位点替换的进化距离。动物剪影表明宿主物种关联。大多数 AAV 血清型,包括 AAV-1 至 AAV-4、AAV-6 至 AAV-12,似乎代表了灵长类动物特异性的多样性,并且是单一物种“灵长类依赖细小病毒 1”的成员(由粉红色括号表示)。尽管这些病毒与灵长类动物有关,但它们与个别灵长类动物的关系尚不确定,因此轮廓显示在括号右侧。然而,它们与猿猴灵长类动物的长期关联通过在猿猴基因组中插入约 2000 万年前的内源细小病毒元件 (EPV) (EPV-Dependo.13) 得到证明,该元件在以下物种的多样性中稳健分组:灵长类动物依赖细小病毒1。与从灵长类动物样本中获得的所有其它 AAV 不同,AAV-5(以红色表示)在有蹄类动物病毒的多样性中表现强劲,并且与山羊 AAV 关系尤其密切。
AAV-5 的非灵长类起源
已发现许多非灵长类哺乳动物物种是依赖细小病毒的宿主,包括蝙蝠、啮齿动物、食肉动物和有蹄类动物。虽然其中一些病毒,例如牛腺相关病毒 (BAAV),早在 20 世纪 70 年代就被发现了,但它们的基因组序列直到许多年后才被表征。然而,当最终获得有蹄类 AAV(包括 BAAV 和“山羊腺相关病毒”(CAAV))的基因组序列时,意外地发现这些病毒物种与 AAV-5 具有密切的进化关系。这些发现表明跨物种转移可能已经发生。
直到最近,由于缺乏有关 AAV 自然生态和多样性的信息,因此很难从 AAV 系统发育中得出有关跨物种转移方向性的可靠结论。然而,自 2000 年代中期以来,病毒基因组测序的巨大进步极大地扩展了我们对病毒多样性的理解,从而可以更可靠地推断宿主与细小病毒的关系。目前的数据表明,AAV 很少在亲缘关系较远的哺乳动物群体之间传播。因此,对 AAV 分离株之间观察到的系统发育关系最简洁的解释是 AAV-5 是否起源于有蹄类动物。
通过宿主物种基因组测序揭示了有关宿主与细小病毒关系的更多信息。这表明源自细小病毒(包括 AAV)的 DNA 序列广泛存在于动物物种的种系基因组中。这些序列被称为“内源性细小病毒元件”(EPV),通常已有数百万年的历史,很可能起源于源自古代细小病毒的 DNA 被整合到祖先宿主物种的种系中时。 EPV 为细小病毒与宿主物种之间的长期共同进化关系提供了独特的见解。 EPV 和当代细小病毒的系统发展表明,在 猕猴灵长类动物中发现的一些 EPV 来自约 1600-2300 万年前传播的当代灵长类 AAV 的古代祖先(图 1)。这些发现表明,AAV 谱系与宿主群体具有稳定、长期的关联,进一步支持 AAV-5 起源于有蹄类动物的观点。
理论上,AAV-5 有蹄类动物向人类传播至少有两种可能发生的情况。一种常见的情况是生物制药产品无意中受到污染,这可能会导致人类感染。 AAV 是众所周知的细胞和病毒培养系统污染物,并且存在多种可能的污染源。其中,来自有蹄类动物的生物材料,例如胎牛血清(FBS),是最有可能的来源。数十年来,FBS 已广泛用于哺乳动物细胞培养,并被认为是外源因子的潜在来源。过去,胎牛血清处理依赖于除菌过滤,这不能消除病毒颗粒。然而,如果 FBS 受到污染,则可能会在多个细胞培养设施中检测到 AAV5 的存在。
另外,由于 AAV5 是从生殖器软骨瘤中分离出来的,因此它在人类中的存在可以通过性接触来解释。由于人类与有蹄类动物密切接触已有数千年,而且 AAV-5 在人群中的血清流行率相对较低,因此跨物种传播可能只会在异常情况下发生。与流行的传说相反,通过动物恋行为发生病毒人畜共患传播的记录实例很少。然而,在这种特殊情况下,可以合理地认为此类行为发挥了作用。获得并检查与获得 AAV-5 的软骨瘤相关的乳头瘤病毒基因组序列可能很有趣,以确定这些序列是否属于人类中常见的病毒基因型,而不是有蹄类动物中发现的病毒基因型。
在图2中,我们提出了 AAV-5 出现和流行病学的四种替代模型,每种模型都是根据 (i) 跨物种传播频率和 (ii) 人际传播程度的差异来定义的。如果 AAV-5 血清学准确反映了 AAV-5 感染的血清转化,那么人群中的流行率可能反映了人与人之间的传播(或药物的大规模污染)。如果血清阳性是由交叉反应抗体(即灵长类 AAV 和 AAV-5 之间的共同表位)引起的,那么这两种 AAV 的血清阳性率预计将高度相关。也许开发提高衣壳特异性和减少交叉反应性的检测方法将有助于解决血清阳性率的不确定性。尽管 AAV-2 和 AAV-5 的主要外壳蛋白 (VP3) 仅具有约 60% 的同一性,但基于线性和结构预测分析的表位预测表明存在几个常见表位。接触 AAV-2 或其它灵长类 AAV 可能产生交叉反应抗体,这意味着衣壳结合抗体无法确定 AAV-5 血清阳性率。
图2 人类AAV-5出现模型。显示 AAV-5 出现的替代模型的矩阵。这些模型是根据以下方面的差异来定义的:(i) 跨物种传播的频率,以及 (ii) 人际传播的程度。在模型 (i) 中,跨物种传播是一种罕见事件,不会继续传播 - 在这种情况下,报告的 AAV-5 血清阳性即使不是人为的,也必然通过人类接触受污染的生物药品而发生。在模型 (ii) 中,AAV-5 的人际传播确实经常发生,并且所有 AAV-5 分离株均源自少数跨物种传播事件,可能不超过一次。该模型可以在不使用受污染的生物药品的情况下解释人类中的 AAV-5 血清阳性,但这意味着它应该有一个明确的分布,在暴露人群中患病率更高。在模型(iii)中,跨物种传播发生得更频繁,但人际传播则不然。在此模型中,AAV 5 血清阳性预计仅发生在直接从有蹄类动物或通过受污染的生物药品感染病毒的个体中。在模型(iv)中,跨物种传播发生得更频繁,其中许多事件导致人与人之间的传播。这可以解释在不涉及受污染的生物药品的情况下,人群中 AAV-5 血清阳性率高的原因,但这违背了进化论的预期,因为最近通过人畜共患病获得的病毒被认为通常在受体宿主物种中具有较低的传播性。
总结
如果如血清学研究表明的那样,AAV-5 感染确实在人群中广泛存在,那么这就提出了几个重要问题。首先,人类感染 AAV-5 是最近才出现的,还是前几年没有被发现?考虑到人类和家养有蹄类动物之间长期存在的相互作用,跨物种传播可能会更早发生。其次,如果确实发生人际传播,AAV-5是否适应了人类宿主?此外,关于 AAV-5 感染的自然途径和体内目标组织也存在问题。对自然循环的 AAV-5 多样性进行小规模、基于序列的探索可以阐明其中许多问题,并提供回答其它问题的途径。
原文:R.J.Gifford, R.M.Kotin, Unraveling the origins of human adeno-associated virus 5. Cell & Gene Therapy Insights 2023; 9(4), 265–273.






