端到端(从种子到单位剂量 - E-2-E)生产代表了大分子和小分子的下一代生物制药生产工艺。它被监管机构认可为一项关键的新兴技术。FDA 已批准了各种小分子产品,并最近发布了连续生产行业指南草案。国际协调委员会发布了 (ICH) Q13,该 Q13 已被欧洲药品管理局 (EMA) 采用,以支持该技术并提供指导。公司可以增加灵活性并最大限度地发挥过程分析 ICH Q14 的价值,以增强 E-2-E 生产。
值得注意的是,过程分析技术 (PAT) 的监管指南包括 ICH Q8(R2)、 ICH Q2(R2)、图 1 以及 FDA 2004 起的“行业指南”。
FDA PAT 指南认为过程分析技术是:
“一种通过及时测量(即在工艺过程中)原材料和中间材料以及工艺的关键质量和性能属性来设计、分析和控制生产的系统,其目标是确保最终产品质量。值得注意的是,过程分析技术中的分析一词被广泛视为包括以综合方式进行的化学、物理、微生物、数学和风险分析。”
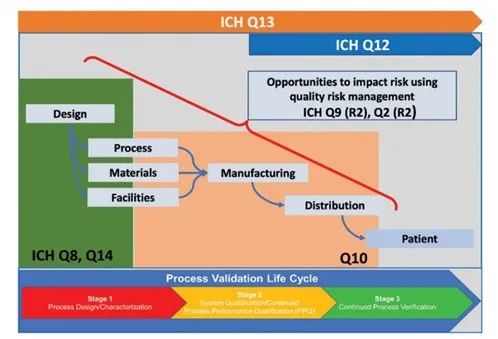
图1. ICH指南链接概述:从规划设计阶段到商业生产的工艺线。
E-2-E 生产分析必须更加贴近工艺。因此,过程分析技术可以为 E-2-E 生产过程的设计、分析和控制增加显著的价值。过程分析技术不涉及过程的合并或保留,可以在实时放行测试 (RTRT) 中做出决策。例如,在设计设备或建模单元操作时,过程分析技术测量用于确定停留时间分布 (RTD) )是至关重要的。在工艺开发过程中,过程分析技术可用于确认令人满意的工艺操作、验证模型、通知废物转移 (DTW) 情况或执行反馈/前馈控制。E-2-E 工艺的控制策略也可能受益于过程分析技术的使用。此外,过程分析技术可直接用于最终关键质量属性 (CQA) 确定,或作为包括关键工艺参数 (CPP) 和关键材料属性 (CMA) 的更复杂模型的输入。
CQA = f[CPP1 +CPP2 +CPP3 +…, CMA1 +CMA2 +CMA3 +…]
在开发和实施商业 E-2-E 生产线时,建议在所有三个阶段(设计、分析和控制)使用过程分析技术,甚至比批次生产更强烈。过程分析技术的使用程度取决于公司和产品,反映了可感知的投资回报。
连续生产在工艺产量、工艺效率、设施利用率和工艺一致性方面比批次操作具有多个优势。这些优势为下一代生物生产设施的设计、建造和运营提供了多种机会。
实施连续生物生产的潜在优势
更高的工艺产量
更高的工艺效率
灵活的设施 » 稳定的生产
提高产品质量
工艺一致性
灵活响应生产需求
减少对可比性的需求
减少生产占地
一次性技术
减少培养基体积
清洁更简单
更好的产品理解
入线/在线监测和控制 (RTRT)
设备可以承受长时间运行
可适应 RTRT 的数字传感器
经验丰富的员工队伍(可以管理 E-2-E 生产)
实施连续生物生产的挑战
工艺复杂度
细胞截留
高细胞密度
混合
通气
过程控制
更长的运行时间
工艺可靠性和稳定性
细胞系稳定性
保持无菌
工艺可放大性(在连续灌流工艺中)
工艺放大
过程一致性和控制
工艺表征
规模缩小模型的复杂性(用于灌流工艺)
工艺优化和表征(针对灌流工艺)
工艺验证
原材料特性和变异性
杂质和去除(产品随着时间的推移而降解)
病毒安全性和生物负荷
物料追溯
细胞系稳定性和寿命
产品知识和结构/功能关系
分析技术与控制策略
设计空间和步骤之间的潜在交互
评估生产变更及其对产品质量的影响
生物生产是一个成熟的行业,生产有价值的药物,用于治疗危及生命的疾病,包括癌症、自身免疫性疾病以及代谢和血液疾病。治疗性蛋白质,如干扰素、凝血因子、酶、疫苗和单克隆抗体 (mAb) )由基因工程微生物、酵母和哺乳动物细胞生产,采用经过验证的工艺,涉及多个单元操作,并采用经过表征和优化的工艺参数。
自生物生产工艺开发初期以来,人们对连续工艺产生了极大的兴趣。带有细胞截留和灌流的连续培养在 20 世纪 80 年代非常流行,因为它可以达到高细胞密度,从而提高单位细胞培养基体积生产率,图2;当时使用的营养物质不是很丰富,因此批次模式下可达到的细胞密度约为 1-2 x10^6 cells/mL。通过以每天 2-10 个生物反应器体积的置换率灌流培养基,连续灌流操作允许生物反应器中的细胞密度增加一个数量级。连续灌流还可以提高可用的不稳定蛋白质的质量,例如酶和凝血因子。
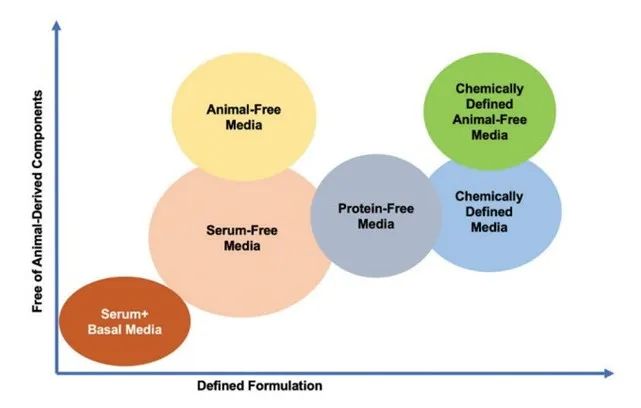
图2. 哺乳动物细胞培养培养基发展的演变。
更高的工艺产量
连续生物生产相对于批次生产的主要优势之一是实现更高的单位体积生产率。表 1 中列出了单克隆抗体生产的批次和连续式工艺的比较,图 3。
更高的工艺效率
批次工艺的运行时间很短,批次之间花费大量时间用于终止、清洁、设备整修以及下一批工艺中间体的准备和构建(停机时间),这会影响循环时间和工厂利用效率。连续工艺可以长时间运行,最大限度地减少停机对整体利用率的影响,图 4 和图 5。
提高产品质量
连续工艺通过提高速度、减少和/或消除工艺过程中的停留时间或保留时间,为生物生产优化提供了机会。减少细胞培养过程中的停留时间对于最大限度地减少不稳定蛋白质产品的降解非常有益。
灵活的设施
灵活设施是一种可以快速重新配置、以生产不同药品的生产设施。灵活的工厂设施可以在相对较短的时间内改变其生产的产品。因此,使用“灵活”一词。灵活工厂的创建者经过精心设计,使其能够提供广泛的操作和服务来生产原料药和药品。
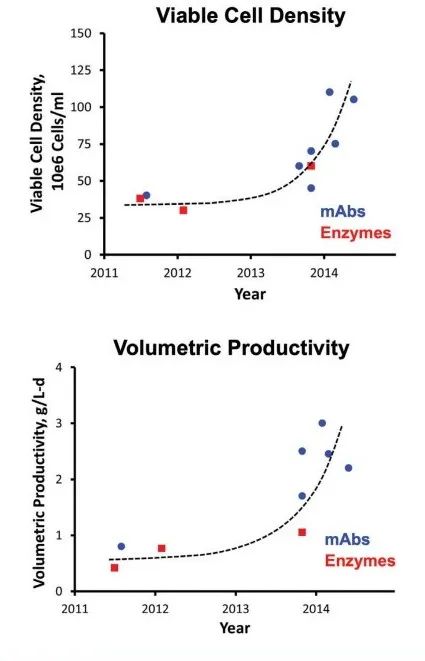
图3. 上游生产能力的快速发展和显著的上升潜力。
使用旨在生产一系列药品中的某些药品的端到端设置。生产线将具有可重新配置的可互换设备/系统,图 6。
表1. 单抗产品批次和连续(灌流)工艺的比较
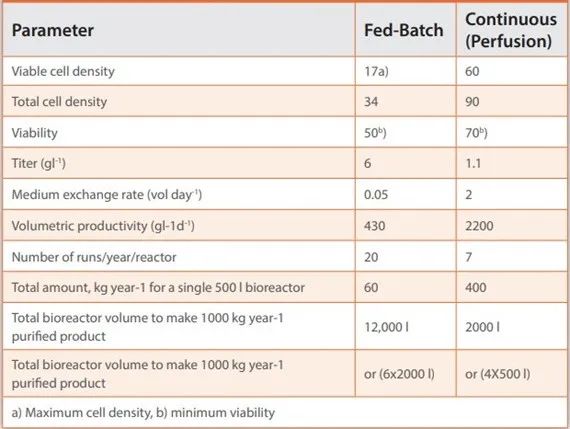
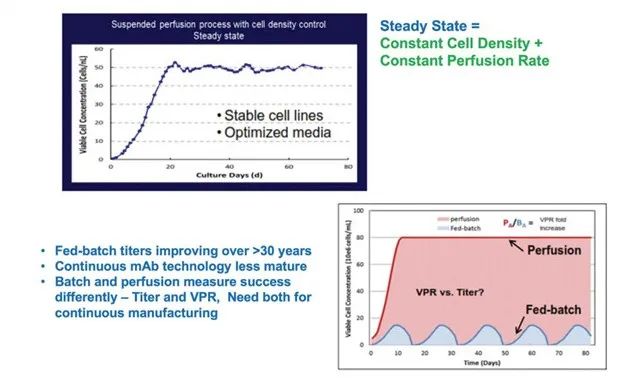
图4. 补料分批与连续生产工艺的比较。
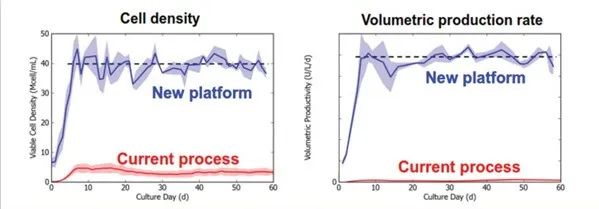
图5. 批次 (当前工艺) vs. 连续 (新平台) 生产。
可放大的生产
E-2-E或连续生产是一种用于不间断地生产、制备或工艺材料的流程生产方法。连续生产被称为连续工艺或连续流工艺,因为正在处理的材料(无论是干散装还是流体)都在连续运动。连续通常意味着每周 7 天、每天 24 小时运行,很少进行维护停机。
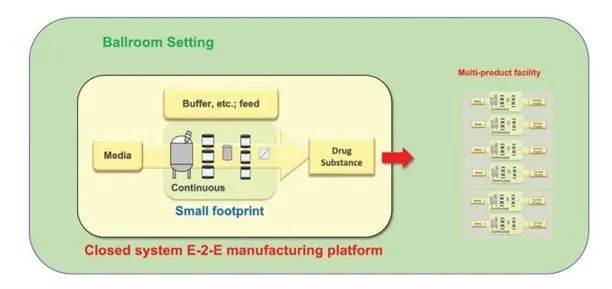
图6. 集成式连续生物生产平台(操作空间)。
放大这样的工艺比放大批次工艺更复杂。通常,连续生产具有固定的设备和系统规模,并且在需要增加产量的情况下,可以规模扩展(scale-out)。通过扩展工艺,可以满足对额外产品的需求,并简化验证和批准工艺。
风险缓解和风险管理
通过及时交付/放行和电子数据集成来缓解风险和消除工艺瓶颈,对于实现连续生物生产至关重要。
更高滴度的单克隆抗体工艺以及更新的细胞和基因治疗产品已将各种新技术引入生物制药市场。虽然这些新技术推动了整个领域的发展,但从监管、质量和供应链的角度来看,它们也给原材料管理带来了一些新的挑战。生产工艺创新可提高灵活性,同时降低药品总体成本,有助于应对一些市场挑战。在改善上游到下游的单元运营方面已经取得了很大进展。
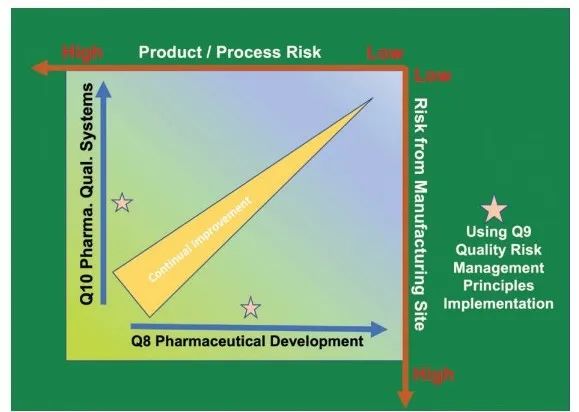
图7. 基于风险的生产,以及ICH Q9如何与ICH Q8以及Q10协作。
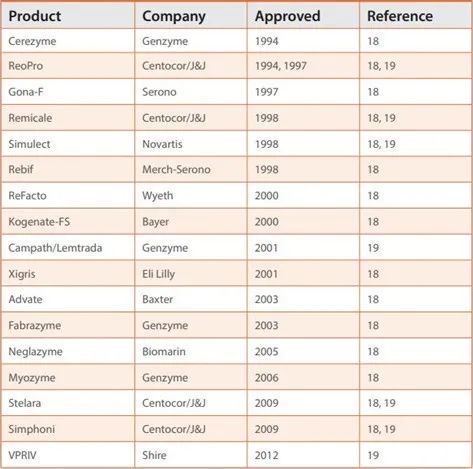
表2. 经批准的、基于连续生物生产的生物药品 (2012年年销售总额达150亿美元)。
然而,要实现功能良好的全集成连续生产,需要克服许多挑战。典型的生物制药生产会消耗数百种原材料,包括培养基、添加物、工艺化学品、过滤器、填料和赋形剂。在不增加库存水平或不实施非传统方法来接收放行的情况下,管理这些组件的流程并及时放行它们是一项艰巨的任务。使用这些材料,同时满足所有质量和法规要求并预测工艺变化是降低生产过程风险的关键。一般来说,建议使用 ICH Q9、Q8 和 Q10 来消除和/或降低风险并保持原料药-药品的安全性、有效性和质量(图 7)。
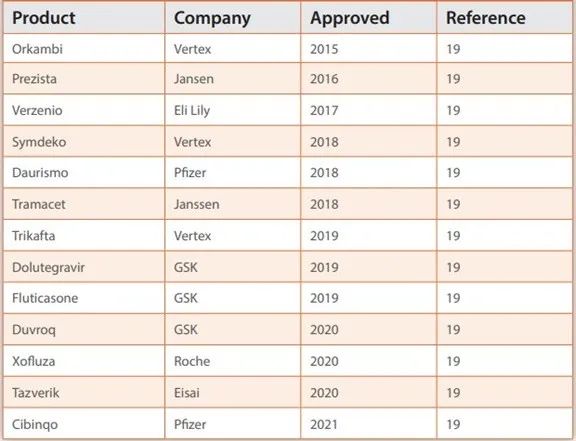
表3. 2015-2021年,FDA批准的、使用连续生产的药物。
尽管已经使用连续细胞培养工艺开发了多种产品,但运行灌流操作以及确保其可靠性、可放大性和可生产性的复杂性阻碍了其被制药行业广泛接受。到 20 世纪 90 年代初,批次操作成为生物生产的首选方法。三个因素在这一举措中发挥了作用:
1、批次操作简单
2、药企聚焦单克隆抗体
3. 补液开发和培养基富集方面的进展,图 2
单克隆抗体是相对稳定的蛋白质,其质量不受停留时间的影响。通过在具有特殊补液溶液和培养基的补料分批中使用优化的补液策略,细胞密度和生产率提高了一个数量级以上。所有这些因素结合在一起,确立了补料分批操作作为选择平台,而连续工艺仍然是特殊分子的唯一选择。
连续工艺是生物生产的重要组成部分,目前市场上的产品数量已超过 90 种(表 2 和表 3)。生物药大约有30多种,包括替代酶、凝血因子、单克隆抗体等。其中一些产品每年产生超过 10 亿美元的收入,其中强生 (J&J) 的 Remicade 2012 年销售额达到约 US$6.8B。
虽然平台技术通常使用补料分批是首选平台,但提高生产率和降低生产成本促使公司考虑替代生产技术。连续工艺与批次工艺相比具有许多优势,并且已在其它行业成功实施。正如所讨论的,在生物生产中使用连续工艺是从培养开始的,将来将其应用于所有生产单元操作是可行的。由于生物工艺工程、自动化和工艺优化的最新进展,与连续工艺实施相关的许多问题已经得到解决。
连续生物生产的优点和缺点
表 4 总结了连续生物制药生产的多方面优势。连续生物工艺平台与不锈钢和一次性批次工艺在临床和商业规模上的模型比较表明,连续操作可以提高一次性技术所带来的节省。长期生产成本的降低可以使追求生物仿制药在经济上对制药公司更具吸引力。
除了负担能力之外,连续生产还可以提高药品的可及性。生产质量失败可能导致药品短缺,连续生产可以提供质量稳定的产品。按需生产(即插即用或即取即用)潜在更高质量药品的能力可以避免生产过剩和延误。
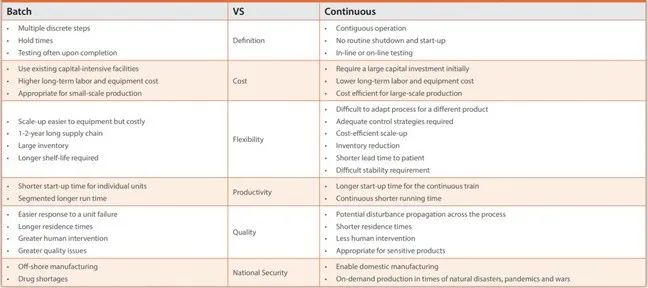
表 4 展示了批次生产工艺与连续生产工艺的比较。
表4. 批次和连续药物生产的比较。
推动创新和卓越运营
过去十年,创新生物制药行业生产和销售的产品性质发生了重大转变。当今的全球生物制药组合反映出治疗竞争的加剧、大分子药物、先进治疗药物产品的普及、个性化或靶向产品数量的增加以及许多孤儿和罕见疾病治疗方法的增加。这些下一代趋势(图 8)催生了生产量极其有限、生产要求高度特定和基因型特定产品的生物制药产品。

图8. 下一代工艺将需要跨越学科和时间的进化之旅。
整体产品组合的根本性转变以及对持续提高生产效率和有效性的关注正在刺激支持先进生物制药生产所需的技术和工艺的发展。生产技术的创新有助于提高经济性、灵活性和质量,同时有可能直接和间接使患者受益。生物制药生产商通常在以下领域进行投资:
连续生产以提高可放大性并加快上市时间,同时降低资本和运营成本,并提高质量
新的工艺分析工具可提高工艺稳健性、加速商业化生产规模并推动更有效地利用资源
一次性系统可提高灵活性并缩短生产周期,同时降低资本投资和能源需求
替代下游工艺技术可提高产量,同时降低成本,绿色化学可减少浪费,新的疫苗和治疗生产方法可提高产能、可放大性和灵活性
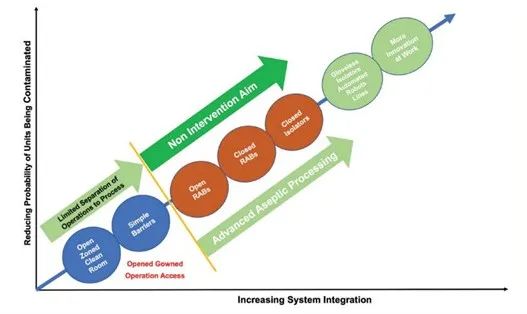
图9. 工艺设备 – 系统创新和技术进步时间线。
图10. 连续缓冲液制备系统。
此外,新型产品即将上市,有助于提高药物有效性并支持患者依从性,例如反映药物递送系统和药物器械组合产品改进的产品。这些产品需要生物制药公司及其供应网络采用先进的生产技术,因为生产过程本身对于药物的有效性变得越来越重要。生物制药产品组合的变化和先进生产技术的兴起对生物制药公司内部和外部产生了影响。因此,自动化、设备设计、传感器技术和设施设计的供应商已加紧支持药物生物生产领域,以配合医学创新,图 9。
缓冲液制备的进展
缓冲器生产和制备方面的进步,无论是节省空间、节省时间还是节省成本,该系统都将支持连续生产,图 10。
连接的缓冲液管理系统在使用时通过在线稀释提供所需的缓冲液,以释放工艺占地面积并简化工作流程,并消除缓冲液制备工艺车间的要求。
这种灵活的自动化系统可满足从中试规模到临床规模生产(高达 1200 lhr-1)的缓冲液需求,并可在目标规格内提供多达 20 倍浓缩物的多达六种不同配方。
混合连续(半连续)生物工艺 (HCB) 平台
商业生产中灌流的实际使用更为广泛,但生物工艺生产商越来越不愿公开分享其工艺的详细信息。需要指出的是,Genzyme、Bayer、Janssen、Merck-Serono、Novartis 和 Eli Lilly等生产商使用灌流或连续工艺元件生产约 19 种上市的重组蛋白和单克隆抗体 (mAb) 产品,这些产品主要是年收入总计约 200 亿美元的“重磅炸弹”产品。
原文:R.Dream, End-to-End Biomanufacturing: Challenges and Opportunities in Implementation. American Pharmaceutical Review, 2023.






