本文节选自来自AGC Inc., 的研究人员发表的文章“CDMOs Play a Critical Role in the Biopharmaceutical Ecosystem”,由于水平有限,详细内容,请参考原文。
千禧年后,生物制药行业取得了显著进步。新型生物药相继研发,重磅药物相继问世。伴随着生物制药需求的增加,出现了一种称为“合同开发和制造组织(CDMO)”的商业模式。 CDMO 受托开发和生产制药公司的生产工艺。在这篇综述中,我们通过分析半导体行业的代工业务,确定生物制药 CDMO 的成功因素。此外,我们还将回顾单克隆抗体生产平台和新技术,它们是生物制药 CDMO 差异化战略的关键方面。
简介
生物制药药物或生物制品是使用生物技术生产的药物的总称。与化学生产的小分子药物不同,生物制品是复杂的分子,例如用作药物成分的蛋白质或细胞。蛋白质疗法在 20 世纪是一个小众市场,但随着 21 世纪抗体药物的出现,它发生了翻天覆地的变化。最终,蛋白质疗法主导了制药行业新药的销售,导致范式转变。 2012 年生物制品在前 100 名药品总销售额中的份额超过 16%,预计到 2026 年将达到 55%。全球处方药中生物制品的销售额继续快速增长,2019 年至 2026 年的年均增长率为 9.6%。此外,已经开发出新的方式,例如基因治疗药物,来治疗未满足的医疗需求。
在生物制药行业取得显著进步的同时,与生物制药公司签订合同进行原料药开发和生产的合同开发和制造组织 (CDMO) 也在同步发展。图 1 显示了制药行业的生态系统,它是生物技术和制药公司的药物发现以及 CDMO 的药物生产的横向划分模型。 2018年生物医药CDMO产业市场规模突破100亿美元,加上抗体药物的不断发展,各种新型生物药不断涌现,扩大了生物医药CDMO市场。预计 2020 年至 2025 年年均增长率为 10.2%,高于小分子药物市场(8.0%)。
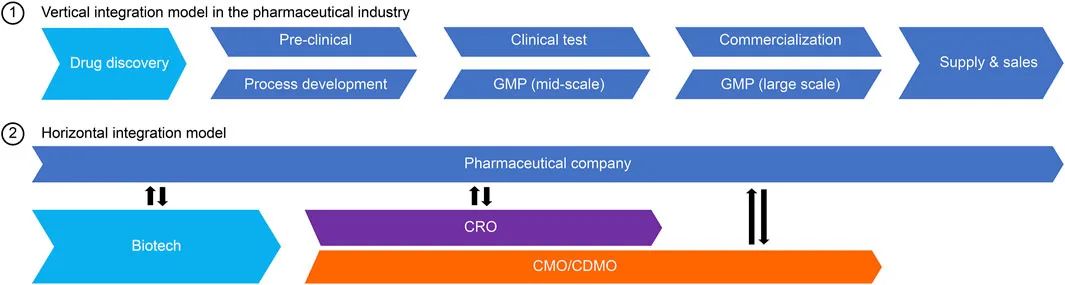
图 1. 制药行业的横向角色划分。
在生物制药行业之前,半导体行业在80年代就建立了横向分工模式。半导体生态系统分为以下三个部分:无晶圆厂、为其他公司生产微芯片的代工厂和集成设备生产商 (IDM)。图2是医药行业和半导体行业的横向商业模式对比。在这个模型中,半导体公司和无晶圆厂公司的设计部门的职位分别对应于制药公司和药物发现初创公司的药物发现部门。尽管每个行业的产品各不相同,但两个行业都承受着新产品和生产技术研发成本增加的负担。半导体行业的发展和技术平台的历史为生物制药 CDMO 行业的关键成功因素提供了见解。
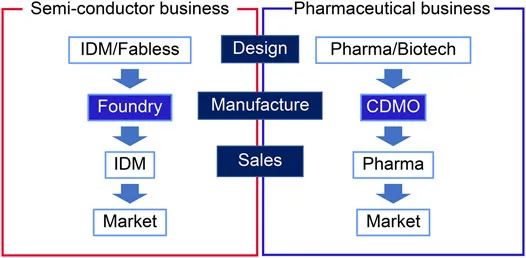
图 2. 半导体和制药行业的比较。
半导体代工成长背景
半导体行业的历史背景对晶圆代工厂的成长有着重大影响。在晶圆代工兴起之前,无晶圆厂公司将生产外包给 IDM。然而,无晶圆厂的发展受制于生产能力和IDM缺乏必要的生产技术。 20世纪80年代,许多无晶圆厂公司随着晶圆代工公司的成立,开始进军半导体业务。这些无晶圆厂公司为半导体芯片的创新做出了重大贡献。在 2000 年代,无晶圆厂公司和其他公司,如谷歌和亚马逊,开始设计专用芯片,并将芯片生产外包给代工厂。由于对半导体生产的需求不断增加,晶圆代工市场在 2018 年达到 736 亿美元,到 2022 年将达到 1512 亿美元。预计到 2025 年复合年增长率将达到 11.6%。
半导体代工厂的成功因素
代工厂的关键成功因素之一是及时确保高质量和高性能半导体产品的供应。随着半导体市场的增长,代工厂需要大量投资,以确保其产能。尽管如此,IDM在生产设备方面也需要大量资金投入,但设备的开工率取决于其新产品的销售情况。因此,运营比率的下降可能是一种管理风险。相比之下,由于晶圆代工厂可以同时接到IDM和无晶圆厂公司的代工订单,因此可以保持生产设备的高运转率。因此,无晶圆厂公司可以专注于设计,代工厂可以专注于确保生产工艺能力。目前,几家实力雄厚的晶圆代工厂在半导体行业处于领先地位。然而,IDM、无晶圆厂和代工厂的共存对于半导体行业的发展将是必要的。
获得新技术是另一个成功因素。微细加工是半导体生产过程中最关键的技术之一。在半导体行业,器件的小型化按照摩尔定律进行(半导体集成率在 18-24 个月内翻一番)。这种微细加工的发展使得增加每单位面积的晶体管数量成为可能,显著有助于提高运行速度和降低功耗。已经发明了先进的工艺技术,例如极紫外 (EUV) 光,以克服使用紫外光的传统曝光设备的微加工限制。近年来,一流的晶圆代工厂迅速引入这些微细加工技术,并发展出基于最新设计规则的芯片生产能力。因此,对具有高生产技术的代工厂的依赖正在增加。
生物制药合同开发和制造组织(CDMO)的成长背景
制药公司还需要将其投资和资源集中用于新药发现。大型制药公司的总研发成本(2006-2014 年)在 10-900 亿美元之间,新药上市数量往往与研发成本成正比。因此,制药公司(相当于半导体行业的 IDM)越来越难以投资于工艺开发和生产,并开始依赖 CDMO(相当于半导体行业的代工厂)。此外,由于生物技术的发展,药物发现生物技术(相当于半导体行业的无晶圆厂)开发了许多针对各种罕见疾病的创新模式。生物技术公司和中小型制药公司越来越多地将生产外包,以避免投资生产设施的风险。
生物制品合同开发和制造组织的成功因素
通过比较半导体代工厂和生物制品合同业务,我们发现他们成功的几个重要共同因素如下:
1)采用先进技术保障生产技术。
2) 确保及时的设备能力。
3) 根据客户要求提供适当的服务。
在半导体行业,随着生产设备的发展,生产技术已经标准化,使得半导体生产外包成为可能。因此,无晶圆厂公司与代工厂合作发展壮大。此外,随着微细加工技术的发展,半导体生产技术取得了显著进步,仅通过购买设备很难创造出产品。代工厂拥有先进的生产技术,结合了复杂的工艺和操作诀窍。在生物制药行业,生物制品,特别是抗体药物,的生产已经标准化。这种标准化使得将生物制药药物的生产外包给 CDMO 变得更加容易。在此背景下,生物制药CDMO的进一步发展将取决于其生产技术的进步。在下一节中,我们将回顾作为主流生物制品的抗体药物的生产技术趋势。我们还将讨论下一代生物制品生产系统的潜力。
抗体药物生产标准化技术助推生物制药合同开发和制造组织业务
抗体是免疫系统用来识别和中和称为抗原的异物的蛋白质。利用结合各种靶分子的能力,许多抗体药物已被开发并投放市场。抗体由两条多肽链组成,一条重链(H)和一条轻链(L),每条多肽链又由两个区域组成,一个恒定区(C)和一个可变区(V)。可变区的互补决定区 (CDR) 对于抗体与其预期靶标结合的能力至关重要。大多数抗体药物是将小鼠单克隆抗体的CDR移植到人源抗体中构建的人源化抗体,表明抗体药物具有几乎相同的理化性质。因此,可以使抗体药物的生产过程标准化。抗体药物生产平台的一般流程由上游和下游工艺组成。上游工艺包括生产细胞系和在生物反应器中培养细胞系的过程,下游工艺包括从培养基中纯化产生的抗体成分、灭活病毒并将其作为药物物质灌装的过程。大多数工艺是批次式的,并由制药厂的良好生产规范 (GMP) 生产过程控制。由于抗体生产过程的标准化,导致生产设备、周边辅助材料、原料系统的标准化。抗体生产的标准化使生物制药公司更容易将其生产外包给生物制药 CDMO。
如上一章所述,半导体行业的晶圆厂通过获取新技术和积累半导体器件生产的可靠记录,确立了半导体生产技术等于或优于 IDM 的地位。我们相信生物制药CDMO可以提供与制药公司同等质量的生产技术。为了在半导体行业建立与晶圆代工类似的地位,生物制药 CDMO 获取和开发独特的生产技术将非常重要。在接下来的章节中,我们将回顾抗体药物生产技术的最新趋势,同时展示生物制药 CDMO 先进技术发展的例子。
细胞系开发过程
各种细胞系已被用于生产抗体药物,但当今最常用的细胞系是中国仓鼠卵巢 (CHO) 细胞。尽管 CHO 细胞除抗体药物外还被用于生产各种蛋白质治疗药物,但就高生产率、糖基化质量和安全性而言,它们是抗体药物最相容的生产细胞。下文描述了 CDMO 对 CHO 细胞进行研究和开发的示例。
为了大规模生产治疗性蛋白质,包括单克隆抗体 (mAb),使用基于二氢叶酸还原酶 (DHFR) 的甲氨蝶呤 (MTX) 选择建立重组中国仓鼠卵巢 (rCHO) 细胞。然而,它需要多轮 MTX 选择,以进行逐步基因扩增,从而导致细胞系生成的时间线更长。 LONZA(瑞士)开发了CHO-GS(谷胱甘肽合成酶)系统来解决这个问题。在 CHO-GS 系统中,高产细胞系的选择基于控制 GS 表达水平与其特异性抑制剂 l-甲硫氨酸亚砜亚胺 (MSX) 浓度之间的平衡。 CHO-GS 系统吸引了从风险投资公司到大型制药公司的广泛客户,因为它只需要一轮 MSX 选择。最近,LONZA 与辉瑞合作开发了一种通过同源重组位点特异性引入抗体基因的方法。与抗体基因随机插入基因组的传统方法相比,该方法制备的细胞可提供稳定的抗体表达水平。 AGC Biologics(美国)还开发了一种 CHEF1 系统,该系统使用 EF-1 α 启动子显著提高了重组蛋白的生产率。 AGC Biologics 进一步开发了一种具有更高抗体生产率的系统,其中选择标记(二氢叶酸还原酶)基因的 DNA 密码子被修饰,以抑制表达,以扩增细胞中引入的质粒基因。
作为最近的趋势,值得注意的是,通过组学分析对代谢途径进行综合分析对于细胞系开发至关重要。例如,对典型CHO细胞亲本株(CHO-K1、CHO-DXB11和CHO-DG44)的系统分析表明,抗体的糖链结构差异是由于所涉及的各种基因表达水平的差异。组学分析也是优化培养基成分的强大工具。Ali等人阐明了培养基中缺乏半胱氨酸是如何降低抗体生产率的。转录组和蛋白质组的分析导致阐明了各种因素(例如内质网应激)影响抗体产生的机制。组学分析方法是提高生产的有效方法。此外,通过基因组编辑技术(例如 CRISPR/Cas9)提高 CHO 细胞抗体生产力的试验正在增加。
培养和纯化工艺
2000 年代初期,大规模生产畅销药物是生物制药 CDMO 行业的主流。然而,近年来,罕见病等生物制品的管线增加,这有利于品种更广、数量更少的生产方案。因此,对高度灵活的一次性反应器的需求增加了。一次性系统是由塑料制成的可抛弃型设备,主要用于生物生产的上游工艺。因为每批生产都是用新的一次性设备准备的,所以不需要清洁和伴随的验证工作。因此,可以比不锈钢生物反应器更快地开始生产。事实证明,一次性反应器和不锈钢反应器之间的产品质量没有差异。
高密度培养或连续培养方法作为上游工艺中降低资本成本和提高生产率的另一种技术引起了人们的关注。连续生产允许在小型设施中进行大量培养。此外,通过连续置换培养基,可以将乳酸或氨等代谢物的浓度保持在较低水平,从而延长细胞的寿命。连续培养可以提高产品质量。与补料分批工艺相比,灌流工艺产生的双特异性抗体聚体明显减少。
通过细胞工程和培养工艺的优化,抗体生产率已显著提高至约 10 g/L 培养物。因此,下游工艺得到了优化。抗体纯化的第一步一般是使用Protein A 的亲和层析,它与抗体的恒定区结合。该步骤需要大量昂贵的Protein A 填料,从而提高了生产成本。连续层析法因解决这一问题而受到关注。有研究开发了连续逆流切向层析法 (CCTC),它可以用较少量的填料有效地纯化抗体。在该方法中,Protein A填料循环流动,不断吸附和解吸抗体;因此,所需的填料用量比批次法少约3倍,而CCTC法纯化抗体的产品质量(HCP、DNA、单分子量馏分)与批次法相当。尽管已经报道了替代填料的开发,但它们是否可以在抗体药物的生产中替代Protein A 填料仍不确定。
下一代生产工艺
端到端的连续生产工艺作为未来有利的生物制品生产系统而备受关注。图 3 描述了使用 (I) 灌流生物反应器、(II) 多柱层析捕获、(III) 病毒灭活、(IV) 膜层析精纯、(V) 浓缩和缓冲液置换以及(VI) 保存过程。连续工艺不需要为每个工艺步骤提取产品,这可以减少生产的总时间和操作员数量以及人为错误和污染的风险。此外,通过实时监控质量,可以实现高度可靠的质量保证。一些成本模拟表明,抗体药物的生产成本将通过持续生产而降低。虽然连续生产工艺生产各种小分子药物,但生物制品的连续生产仍在开发中。已经报道了实验室规模的抗体药物的完整连续生产工艺。使用该方法,成功连续培养 18 天,与批次法相比,产品质量可以接受。
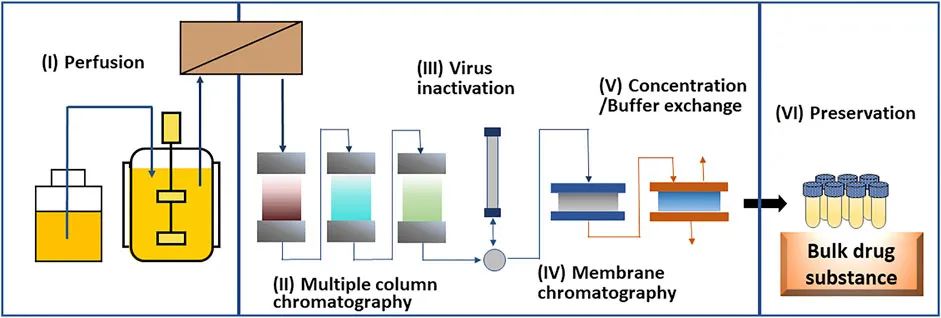
图 3. 治疗性单克隆抗体的端到端连续生产工艺过程示意图。
尽管有上面讨论的优点,但迄今为止在实施连续生产方面的进展似乎比预期的要慢。这主要是因为连续工艺的开发和实施需要很长时间才能收回初始投资。Badman等人提出了一些有趣的想法,例如税收和监管激励措施,以促进从批次工艺系统到连续系统的过渡。由于系统的高度复杂性,连续生产方法的使用也受到限制。尽管监控和数据采集 (SCADA) 等数字技术也得到了发展,但要在实际环境中实现生物制品的端到端连续生产,仍有改进的空间。过程分析技术 (PAT) 已在批次或补料分批操作中得到发展。我们相信,PAT 与数字数据管理系统相结合的进一步发展也将有助于向生物制药行业的连续生产过渡。
结论
在生物制药行业,在药物发现和生产过程中都发生了许多技术创新。与此同时,医药行业的横向分工模式也变得必不可少;生物制药公司(和生物技术公司)更专注于药物发现和开发,而 CDMO 更专注于工艺开发和生产。生物制药 CDMO 可以向半导体行业学习,其中代工厂建立了类似于 IDM 的技术地位。 CDMO 加大技术开发投资和获取新技术以保持竞争优势将更为关键。我们相信,通过持续支持生物制药行业生产针对更多疾病的生物药物,CDMO 将为健康生活做出重大贡献。
原文:H.Kurata, T.Ishino, Y.Ohshima, et al., CDMOs Play a Critical Role in the Biopharmaceutical Ecosystem. Front. Bioeng. Biotechnol., 2022.






