流行病防范创新联盟(Coalition for Epidemic Preparedness Innovations, CEPI)提出了一个“100天任务”,或“登月”计划,将从病原体鉴定到推出新疫苗的时间压缩到100天。与此同时,还认识到第二个100天的重要性,即大规模推出一种新疫苗。具有已知安全性、免疫原性、生产和分发特征的疫苗平台技术对于应对这些挑战至关重要。
新疫苗的临床前和临床开发的许多特点是独立于平台技术的。在基于不同平台部署疫苗的途径中,生产和分发是主要的分歧点。在这里,我们表明,腺病毒载体疫苗的“快速响应”生产可以缩短开发时间表,与其它平台竞争,在此,我们将讨论改进疫苗生产对未来疫情应对和公平获得疫苗的影响。
腺病毒载体提供了一个快速适应和可部署的平台,具有经过验证的安全性和有效性,在实现公平获取方面具有特别优势。牛津大学和阿斯利康基于黑猩猩腺病毒平台开发的Vaxzevria (ChAdOx1 nCoV-19) COVID-19疫苗估计在2021年挽救了约600万人的生命。对79项实际有效性研究的回顾证实了其对死亡或严重疾病的高疗效。伴血小板减少综合征的血栓形成在腺病毒载体疫苗接种者中很少发生,在欧洲和北美以外的数据集中更为罕见。在许多情况下 - 包括对高死亡率病原体的应急反应和没有现有疫苗的情况下 - 这种综合征的发生频率对疫苗接种的风险/效益平衡影响不大。
我们与阿斯利康和其它工业合作伙伴一起开发了一种简单的生产工艺,在五大洲12个国家的设施网络中生产了30多亿剂。生产成本低,而且疫苗适合冷藏而不是冷冻储存,因此能够向难以获得服务的社区,特别是中低收入国家,分发疫苗。
然而,除了这些积极的特征外,腺病毒生产也有两个明显的缺点。首先,准备病毒种子作为生产的起始材料所花费的时间延迟了临床试验的首批可用性。2020年,在病原体序列发表63天后,首次在人体中使用了mRNA SARS-CoV-2疫苗。第一批ChAdOx1 nCoV-19临床批次直到一个月后才放行。其次,mRNA疫苗的单位体积生产力 (每升生物反应器容量的剂量数) 估计至少比ChAdOx1 nCoV-19疫苗每升大约2000剂的数值高一个数量级。这就需要更大的“占地”来生产腺病毒载体原料药 (疫苗原液)。
我们最近发表了一篇文章,试图解决这些问题。我们表明,简化病毒种子生产可以在新病原体序列可用的60天内放行第一批用于临床试验的疫苗批次,并在100天内放行第一批大规模商业批次 (图1a)。我们还发现,与商业化生产ChAdOx1 nCoV-19的工艺相比,强化上游工艺 (即细胞培养和病毒复制) 可以使单位体积生产力提高四倍。改进后的工艺每升生物反应器培养产生约8 × 10^14纯化原料药病毒颗粒(VP),足以生产>10,000剂药品。
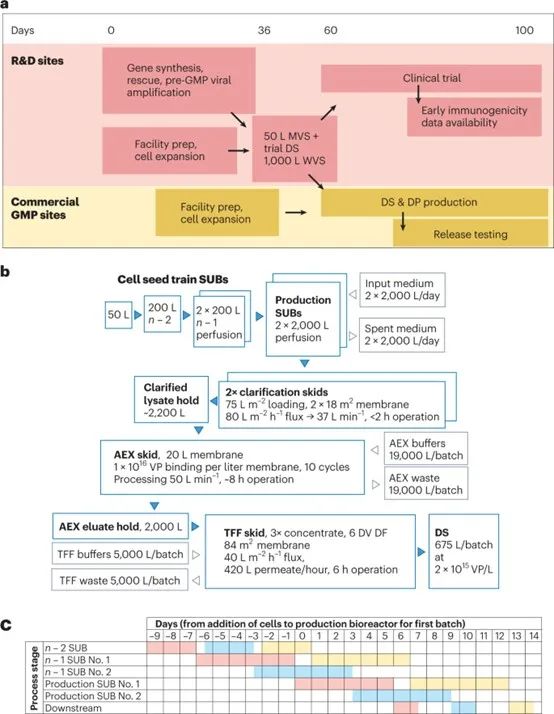
图1:加速高产量腺病毒生产。a.开发活动的高水平概述,包括种子生产、临床试验疫苗供应、临床试验执行和大规模生产,从而能够在第100天放行第一批商业规模的批次。b、设备、产品和物料在模拟设施中的流动。c、生产计划说明,显示使用两个n - 1反应器,两个生产生物反应器和一个下游纯化链。粉色、蓝色和黄色分别表示第一批、第二批和第三批。
我们现在描述这种改进的生产工艺的商业规模实施的技术经济模型 (图1b)。使用Biosolve Process 8软件(Biopharm Services) 构建和评估模型。我们模拟了一个设施,该设施使用一个200 L的“n- 2”生物反应器,用于交替接种两个200 L灌注 “n- 1”生物反应器,依次为两个2000 L生产生物反应器和一个下游纯化装置提供服务。以下假设基于我们发表的数据:细胞倍增时间36 h;上游工艺生产率1.5 × 10^12 VP/mL;收获时benzonase核酸酶浓度100 units/mL;澄清过滤器上样可达1 × 10^12 cells/m2,对应75 L/m2,峰值细胞密度1 × 10^7 cells/mL,安全系数为33%;澄清产物回收率66%;阴离子交换膜结合容量1 × 10^16 VP/L;阴离子交换回收率90%;切向流过滤过滤器上样2 × 10^16 VP/m2。切向流过滤阶段的浓度限制在生物反应器体积的0.33倍,对应于2.2 × 10^12 VP/mL的预期产物浓度。成本基于赛多利斯和Biosolve的专有数据库。
这种生物反应器配置可以每3.5天提供一批 (图1c)。与缺乏种子灌流扩增和使用一次性生产生物反应器的设施相比,这一设施的产量增加了一倍以上。在n - 1条件下使用灌流使细胞扩增更多,减少了生产生物反应器的周期时间。一个纯化链仍然足以处理两个生产反应器的输出。下游工艺可以通过对用于全球生产ChAdOx1 nCoV-19的设备进行适度修改来执行。虽然与其它工艺阶段相比,AEX所需的缓冲液体积很大,但对于许多设施来说,通过使用缓冲浓缩液和在线稀释技术,这些缓冲液可能是可控的。到目前为止,我们还没有优化最终的切向流过滤,以最小化所需的膜面积,我们的模型基于我们未优化的经验,使用了谨慎的假设。预计每批切向流过滤膜面积为84 m2,这突出了这种优化的必要性,但仍然可以使用定制的切向流过滤系统或在现成的系统上进行多次循环来实现。
假设设施使用率为70%,预计单个这样的设施每年可生产约13亿剂,原料药成本低于每剂0.11美元 (低于用于生产ChAdOx1 nCoV-19的补料分批工艺)。这相当于每天每升生物反应器容量大约输出900剂。建造和装备这一设施的资本支出约为4300万美元,每年的业务支出不到1.1亿美元。
在应急响应的短期最大产能运行的替代假设下,我们估计8个这样的设施(即已安装的生物反应器总产能为32,000 L)每月可提供总共10亿剂。虽然规模很大,但这将小于2021年生产ChAdOx1 nCoV-19的设施网络。我们认为,一些现有设施 (包括一些低收入和中等收入国家的设施) 将是合适的。
这些结果对防范未来的大流行具有若干意义。
在我们改进腺病毒生产平台的工作中,我们最初专注于三个基于时间的指标:从病原体序列可用性到放行第一批临床试验批次、第一批商业批次和第10亿剂的时间。与2020年的情况相比,我们认为腺病毒生产和其它平台技术现在都有能力满足CEPI“100天”的目标。在比这短得多的时间内完成临床前和临床开发似乎不太可能。在第二个一百天内,我们的模型表明,一个准备充分的全球努力,使用一个实际规模的生产网络,可以放行超过30亿剂。这足以为全球很大一部分人口提供第一剂疫苗,其产出水平是任何COVID-19疫苗规划都需要两年多才能达到的。
在2020年至2022年期间,技术上可行的疫苗生产速度发生了阶段性变化。现在,实现这样的生产速度已经不是技术可行性的问题,主要是资金和准备的问题,包括降低失败风险和提前准备监管文件模板。在我们看来,我们所描述的工艺的一个完全验证的版本,最好包括一个独立的并行种子生产“备份活动”,并由快速周转平台分析支持,将提供更高的成功“信心”。
质量控制测试限制了疫苗的可获得性。我们建议的时间表 (图1a) 允许第一批临床试验批次的放行测试16天,第一批商业批次的测试35天。这一差异是由于对商业物料采用28天体外培养法检测外源性病毒物质和具有复制能力的腺病毒,而对临床试验材料采用基于核酸的检测 (支持14天体外检测)。充分验证PCR或下一代基于测序的污染物检测方法,可以将第一批商业批次的放行提前到第80天或更早。
进一步的改进是可能的。然而,从生产的角度来看,任何疫苗平台都可能具有竞争力,因为它能够在100天内实现第一批商业批次,每天每升生物反应器容量生产1,000剂,并且每剂原料药的成本< 1美元。进一步的改进可能提供相对较小的效益。领先的疫苗平台现在已经达到了所需的生产速度和设施生产力的水平,在这种水平上,其它因素可能更为重要。这些考虑因素包括安全性、耐受性、有效性、稳定性、成本、方案适用性、个体接受者偏好以及生产商支持技术转移的意愿。在不同情况下选择不同的疫苗可能有合理的科学理由。
未来的流行病是不可避免的。及时获得多种疫苗 (包括腺病毒) 对于保护公众健康是必要的。我们认为,维持一个区域性设施网络 “预热” (预先配备人员、预先储备物料和预先融资),以生产任何十亿剂规模的腺病毒载体疫苗,作为一种全球公共产品,在经济上是有吸引力的。在我们的模型的基础上,每年可能需要花费不到2.2亿美元来资助一个全球设施网络,该网络能够在发现一种新的病原体后的200天内向许多国家提供10亿剂腺病毒载体疫苗。这一估计是基于拥有足够的物料和耗材库存,以生产10亿剂 (55批,每批提供约1800万剂,物料和耗材每批约130万美元),并每12个月更新一次库存。一些物料和耗材的保质期将超过12个月,降低成本,但不包括仓储成本。快速响应需要利用已有的设施 - 例如,在两次流行病之间生产其它疫苗或生物制品的合同生产组织的设施 - 并就发生大流行时的紧急"随叫随到"权利合同进行谈判。利用现有设施将降低资本投入和劳动力成本,尽管预计这些成本只占疫苗生产总成本的一小部分。一个关键的不确定因素是设施紧急可用性的费用。在两次大流行之间,这将需要维持对工作人员的培训和工艺验证,可能需要间歇地执行该工艺,而且 - 至关重要的是 - 将防止使用该设施生产不允许中断数月的产品。我们的估计是假设每个设施每年可以以大约1100万至1600万美元的价格获得这种可随时进入的能力,这在五年的时间里接近一个专门建造的设施的总资本和劳动力成本。采用类似工艺生产另一种用于非大流行适应症的病毒载体的设施,或将八个生产链集中在较少数量的设施中,可能会获得更高的成本效益。
建立这种“预热”网络的成本很高,但仅相当于COVID-19大流行12.5万亿美元全球成本的0.002% (据国际货币基金组织估计),或2021年全球COVID-19疫苗支出的0.4%左右。哪个实体可能资助和委托这样一个腺病毒网络或任何其它疫苗平台,这对全球决策者来说是一个悬而未决的问题,因为这超出了CEPI支持研究和开发的核心角色。
原文:C.C.D.Joe, N.Chopra, P.Nestola, et al., Rapid-response manufacturing of adenovirus-vectored vaccines. Nature Biotechnology, 2023.






