使用病毒载体作为多种应用(如疫苗、癌症治疗或基因疗法)的治疗产品一直呈指数增长。因此,需要改进生产工艺,来应对临床试验和最终商业化所需的大量功能性颗粒。亲和层析 (AC) 可用于简化纯化工艺并生成具有高滴度和纯度的临床级产品。然而,使用 AC 纯化慢病毒载体 (LV) 的主要挑战之一是将高度特异性的配基与温和的洗脱条件相结合,以确保保持载体生物活性。在这项工作中,我们首次报告了 AC 填料的使用,以特异性纯化 VSV-G 假型 LV。配基筛选后,评估和优化了不同的关键工艺参数。测定了每毫升填料 1 × 10^11 总颗粒的动态载量,发现小规模纯化工艺的平均回收率为 45%。建立的 AC的稳健性通过提供 54% 感染性颗粒收率的中间规模测试得到证实,这证明了 AC 基质的可放大性和可重复性。总的来说,这项工作通过提供一种纯化技术来提高下游工艺效率,该技术可以一步实现高纯度、可放大性和工艺强化,从而有助于缩短上市时间。
慢病毒载体 (LV) 是逆转录病毒科的一个复杂亚类,已成为细胞和基因治疗中最常用的递送工具之一。人们对 LV 越来越感兴趣主要是因为它们能够转导增殖和非增殖细胞、整合和递送长期基因表达,以及与 γ 逆转录病毒载体相比提供更安全的整合特性。这种囊膜病毒作为一种多功能工具脱颖而出,因为它可用于治疗传染病或遗传性疾病,甚至可以用于制备针对肿瘤免疫疗法的嵌合抗原受体 (CAR)-T 细胞。在可用的几种囊膜中,水泡性口炎病毒 (VSV-G) 的 G 蛋白最常用于开发研究或临床应用,因为它具有广泛的嗜性和相对较高的稳定性。用临床相关的糖蛋白替代天然囊膜蛋白,即假型,是 LV 的另一个属性。值得注意的是,在市场上已有的 20 多种细胞和基因产品列表中,有 7 种是基于 LV 的疗法,证明了这种病毒载体的成功。尽管体外或体内应用的治疗剂量没有严格标准化的值,但大多数研究报告的病毒剂量在每位患者 10^10 到 10^12 之间。对 LV 日益增长的兴趣突显了当前下游工艺 (DSP) 的瓶颈。
LV 以其生物学复杂性而闻名,因为病毒稳定性会受到温度、离子强度、pH、冻融循环和剪切应力的影响。尽管在过去几年中取得了重大改进,但 LV 的生产和纯化远未发挥其最大潜力。目前,生产平台无法满足临床需求,从而加强了对稳健、可放大且具有成本效益的工艺的需求,以支持新的、基于 LV 的疗法的商业。 LV 的下游工艺包括几个操作单元,其中主要目标包括病毒的浓缩和纯化,同时保持生物活性。病毒捕获可能是 LV 纯化过程中最具挑战性的操作步骤之一,因此,已经研究了不同的层析模式,作为克服低回收率的替代方法。亲和层析 (AC) 探索固定配基与目标产物之间的高选择性和可逆相互作用,一步提供高纯度、高倍数浓缩和可放大性。这种稳健的模式可以产生经济效益,因为它通过减少单元操作的数量来提高工艺标准化和简化。
因此,已经有文献描述了使用亲和层析纯化 LV 的不同方法。固定化金属亲和层析 (IMAC) 涉及带有组氨酸标签 (his-tag) 的囊膜蛋白工程,提供了一种低成本且高度稳定的解决方案。然而,对导致病毒失活的苛刻解吸剂(例如咪唑或 EDTA)或在进一步临床应用中可能产生的不利影响(例如蛋白酶、组氨酸标签配基、金属离子泄漏)的担忧一直是一个主要缺点。另一种囊膜亲和标签策略是将生物素表达到 LV 表面,以便用固定化链霉亲和素进行捕获。最近,Mekkaoui 等人还描述了用 cTag8 标记的 RDPro 假型 LV 的纯化。其中生物素模拟物是基因编码的,并且与假型无关。此外,肝素亲和性可能是另一项有吸引力的技术,因为它成本低廉,且洗脱步骤温和,有助于病毒稳定性。然而,缺乏选择性会导致 DNA 和宿主细胞蛋白 (HCP) 共洗脱。此外,大多数商业化肝素配基都来自动物,这给临床应用带来了一些限制,因为原材料的可追溯性和验证可能具有挑战性。因此,这突出了对亲和层析步骤的需求,该步骤可以使用与囊膜病毒载体的生物活性相容的温和洗脱条件提供高特异性和可放大性。
近年来,已经有多项研究报道了重组骆驼来源单域抗体片段 (VHH) 用于多种生物制药,例如不同的 AAV 血清型;最近,Moleirinho (2020) 等人使用类似的技术开发了用于去除杆状病毒的负模式 AC。由于体积小、特异性高、洗脱条件温和且不含动物源性成分,VHH 配基可以作为一种替代方法来减轻亲和方法中的一些问题。
在这项工作中,成功建立了第一个特异性结合到 VSV-G 假型 LV 的亲和基质设计。首先,通过噬菌体展示产生的一组配基,在温和条件下筛选病毒特异性和洗脱效率。使用功能测定法对主要候选物进行评估,以确定最佳表现者。此外,还对主要候选物的关键工艺参数进行了评估和优化。之后,确定了不同规模下已建立的 Lenti VSVG 亲和基质的全部性能。最后,用新型亲和基质纯化的 LV 在杂质去除和质量属性方面进行了表征。
详细实验操作、结果和讨论,请参考原文。
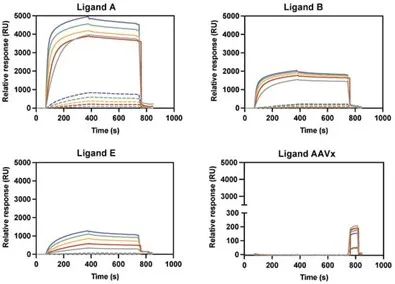
图 1. 使用生物素-配基偶联物的 LV 结合反应。包含相对响应 (RU) 与时间 (s) 的 代表性SPR 传感图。在 VSVG-LV 和新型配基之间观察到的三种不同的相互作用特征由配基 A、B、E 和 AAVX 配基的阴性对照说明。对于每个配基,通过改变注射的 VSVG-LV 原料的稀释度(从 10 倍到 160 倍的倍比稀释)获得不同的结合反应。颜色代码:蓝色代表10倍稀释,绿色代表20倍稀释,黄色代表40倍稀释,红色代表80倍稀释,灰色代表160倍稀释。实线表示使用点到 Strep G Senseye 生物传感器芯片上的最大生物素化 VHH 片段浓度 (20 μg/mL) 进行的实验,而虚线表示使用的最小浓度 (0.02 μg/mL)。
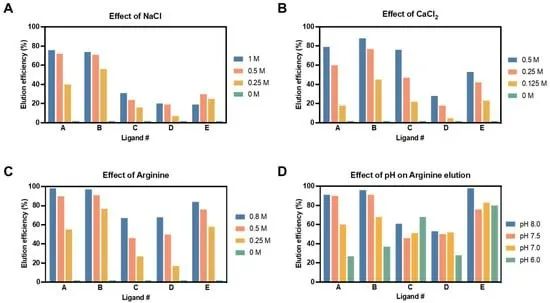
图 2. 使用生物素-配基偶联物的 LV 释放效率。不同解吸缓冲液,包括氯化钠 (A)、氯化钙 (B) 和精氨酸 (C) 对通过 SPR 测定评估的候选配基的洗脱效率 (%) 的影响。缓冲液洗脱优化包括三个浓度。(D) 使用中间精氨酸浓度 0.5 M,在四个 pH 值(8.0、7.5、7.0 和 6.0)下研究洗脱 pH 值对洗脱效率 (%) 的影响。
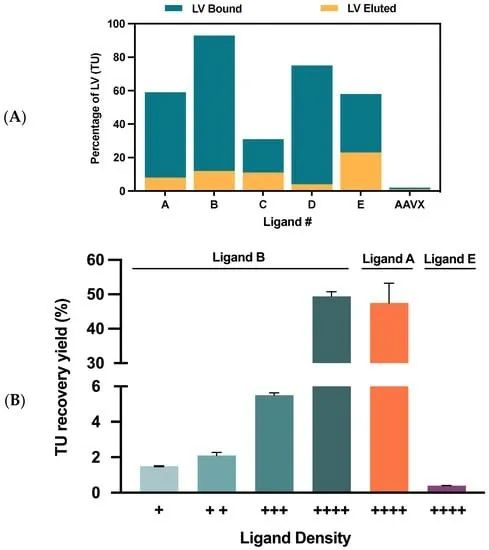
图 3. 先导亲和配基候选物选择。(A) 使用生物素化配基功能化的链霉亲和素琼脂糖基球进行吸附介质筛选(A 至 E)。不同配基之间转导单元的消耗(蓝色条)和洗脱(黄色条)比较。AAVX 配基作为阴性对照。(B) 在最高配基密度 (++++) 下,转导单元在 A、B 和 E 吸附介质原型之间的回收率比较。配基密度对配基 B 的影响被评估,因为它被证明是领先的候选物。配基密度从评估的最低 (+) 到最高 (++++) 值排序。颜色代码:绿色阴影的四个条对应配基 A 的不同配基密度,橙色对应配基 B,紫色条对应配基 E。
表 1. 为建立新型亲和填料而探索的基质的特性。
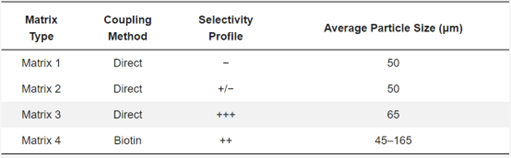
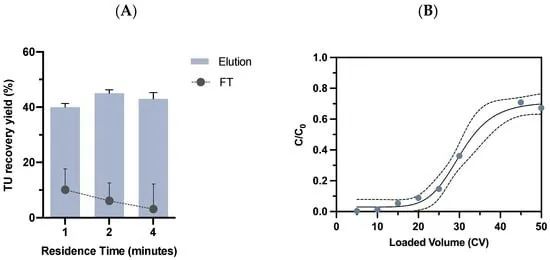
图 4. 新型亲和吸附介质的工艺参数优化。(A) 比较不同保留时间(1、2 和 4 分钟)的 VSVG-LV 回收率结果。对于每种情况,估计病毒回收和病毒损失。(B) Lenti VSVG 亲和基质的穿透曲线表示。澄清的 VSVG-LV 以 72 cm/h 的流速上样到 1 mL 填充床中。C 是流穿样品中病毒总颗粒的浓度,C0 是原料的病毒浓度,C0/C 比率由蓝点表示。虚线表示 95% 置信区间。通过检测 p24 蛋白来估计总颗粒浓度。
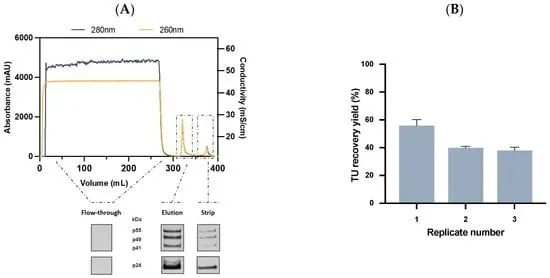
图 5. 用于慢病毒载体纯化的新型亲和层析的评估。(A) 使用 1 mL 规模和 2 分钟保留时间的 Lenti VSVG 亲和基质纯化 VSVG-LV 的色谱图(顶部)和使用抗 p24 抗体检测(底部)的流穿、洗脱和淋洗馏分的 Western blot信号趋势。蓝线和黄线分别代表 280 nm 和 260 nm 处的吸光度。(B) VSVG 亲和填料在 1 mL 规模下的纯化性能。TU 回收率 (%) 代表每个重复 (n = 3)。
表 2. 使用新型 Lenti VSVG 亲和基质进行的中等规模(10 mL 填料)纯化工艺的 LV 质量评估。
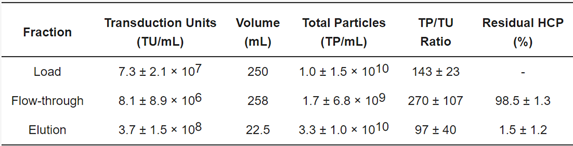
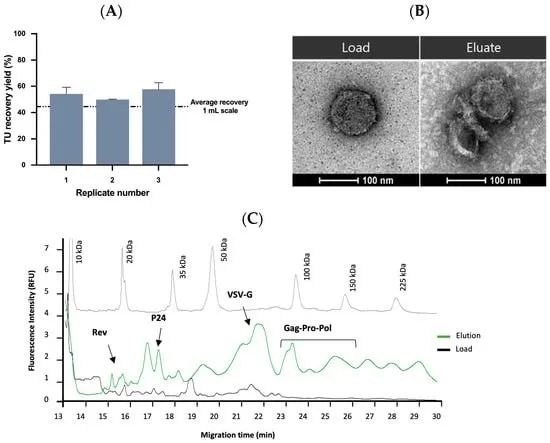
图 6. 纯化的 VSVG-LV 的规模放大和表征。(A) 10 mL 规模的 VSVG-LV 纯化。该图表示每个重复 (n = 3) 的 TU 收率 (%)。虚线显示从 1 mL 规模获得的平均回收率 (45 ± 10%)。(B) VSVG-LV 初始样品(左图)和使用 Lenti VSVG 亲和基质纯化后的样品(右图)的 TEM 分析。(C) 电泳图表示分子量标记(灰线)、澄清的 VSVG-LV 样品(黑线),以及使用带有 LIF 检测器的 CE-SDS 使用 Lenti VSVG 亲和基质(绿线)纯化的 VSVG-LV。图中显示了主要的 VSVG-LV 蛋白质。
总结
如今,由于基因治疗以及基于细胞的产品在个性化医疗方面的巨大潜力,对它们的需求正在快速增长。关于基于 LV 的疗法,由于缺乏简单且可放大的纯化工艺序列,下游工艺仍然具有挑战性。本文描述了一种基于 CaptureSelect™ 技术的新型亲和基质的发现和实施,该技术首次实现了使用 VSV-G 囊膜假型化 LV 的捕获。与现有技术相比,新型吸附介质实现了具有竞争力的收率和杂质清除率。在这项工作中取得的结果证明了这种新型吸附介质的适用性,它提供了高选择性、高纯度、可放大性以及温和的洗脱条件。这些特性使 Lenti VSVG 亲和基质成为传统 AEX 层析的可靠替代品。此外,实现的高效纯化和工艺简化可以缩短上市时间,并为应对大规模 LV 纯化的挑战开辟新的可能性。
原文:A.S.Moreira, S.Bezemer, T.Q.Fria, et al., Implementation of Novel Affinity Ligand for Lentiviral Vector Purification. International Journal of Molecular Sciences, 2023.






