基于抗体的生物疗法是制药市场增长最快的细分市场之一,因为它们具有高选择性和理想的药理学特性,如更长的半衰期,从而相比小分子药物更加安全有效。截至2021年11月21日,美国和欧盟共有131种抗体药物获得批准。此外,临床开发中的抗体数量(I-III期)也在极速增长。2021年,全球抗体药物市场达到2173亿美元,预计在未来十年内将以约15%的年增长率增长。
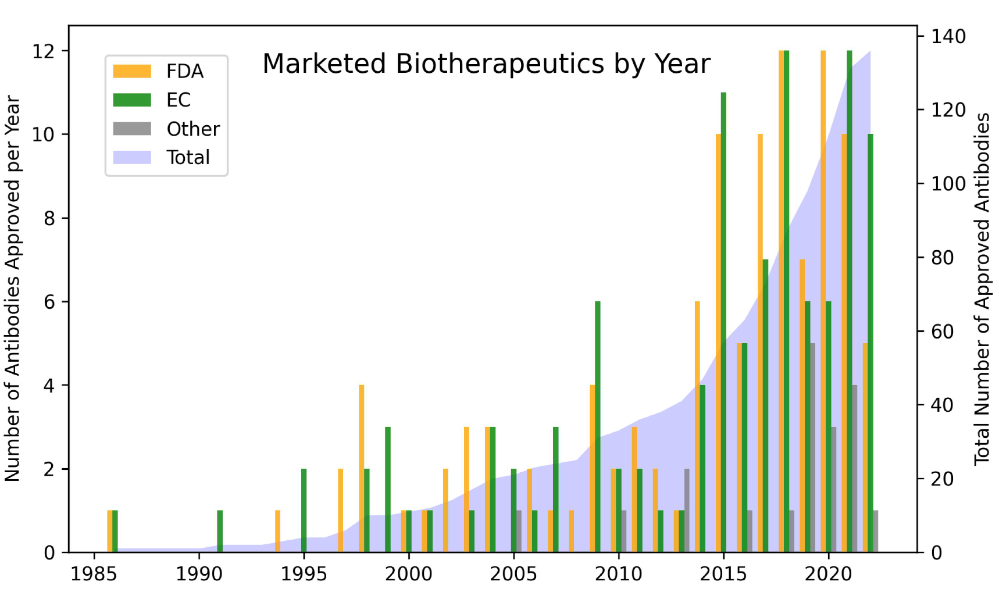
抗体药物的开发和发展是高度动态变化的,了解抗体药物的产业化趋势有助于我们发现和设计更具开发潜力的候选药物。基于截至2020年6月批准的89种抗体药物的信息,如抗体形式、类型、制剂、pH值、活性药物成分(API)浓度以及给药途径,我们可以了解抗体药物在治疗目的、安全性、可开发性、PK和患者便利性方面的趋势。这些分析结果将有助于我们理解抗体药物的发展前景,并提高抗体药物获批的成功率。
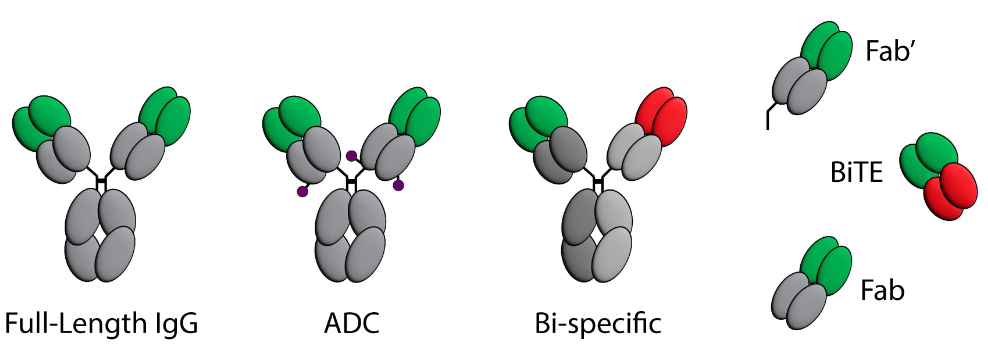
上市的抗体生物有多种分子形式,这89种单克隆抗体中有82种(92%)是全长的单克隆抗体,有1个是全长IgG的双特异性抗体(emicizumab)。在剩下的六个中,一个是双特异性T细胞结合器(blinatumomab),它由靶向CD3和CD19的scFv连接组成;三种是抗原结合片段(Fab),包括abciximab, idarucizumab和anibizumab;一种是Fab’(certolizumab pegol),这是一种在铰链区下方被切割的Fab;最后一种只包含抗体的可变区(Fv),该可变区与一种名为PE38的外毒素融合。在这89种基于抗体的药物中,有7种抗体偶联药物(ADC),其中抗体与小分子细胞毒性药物有效载荷偶联。
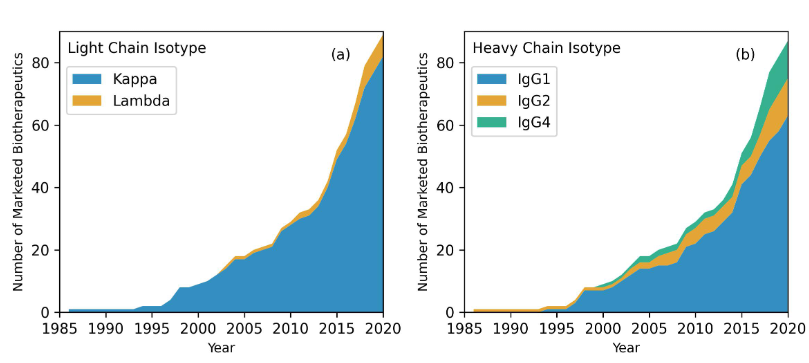
此外,分析的89种抗体药物中包含91个Fvs,因为其中有两个是双特异性抗体。在91个Fv中,84(92%)个Fv的轻链为κ链,其余7个(8%)为λ链。大多数上市的抗体药物使用的重链亚型是IgG1,占到统计的抗体药物的72.4%,另外分别有12个使用了IgG2重链和IgG4重链。
抗体药物的类型包括以下四种:鼠源、嵌合体、人源化和全人源。在这89个抗体药物中,有42个属于人源化抗体,有31个全人源抗体。1986年,FDA批准了第一个鼠源抗体(muromonab),然而由于免疫系统的激活,鼠源抗体可能会引发免疫原性相关副作用。到了1994年,FDA批准了第一个人鼠嵌合抗体(abciximab);1997年批准了第一个人源化抗体(daclizumab);2002年,adalimumab成为第一个获得批准的全人源抗体。
自2003年开始,人源化和全人源抗体的批准率超过了嵌合抗体和鼠源抗体。类似地,抗体药物的重链和轻链可变区(VH和VL)的人源百分比随着时间的推移而增加。平均而言,VH的人源化程度比VL略低 (86% vs 83%)。
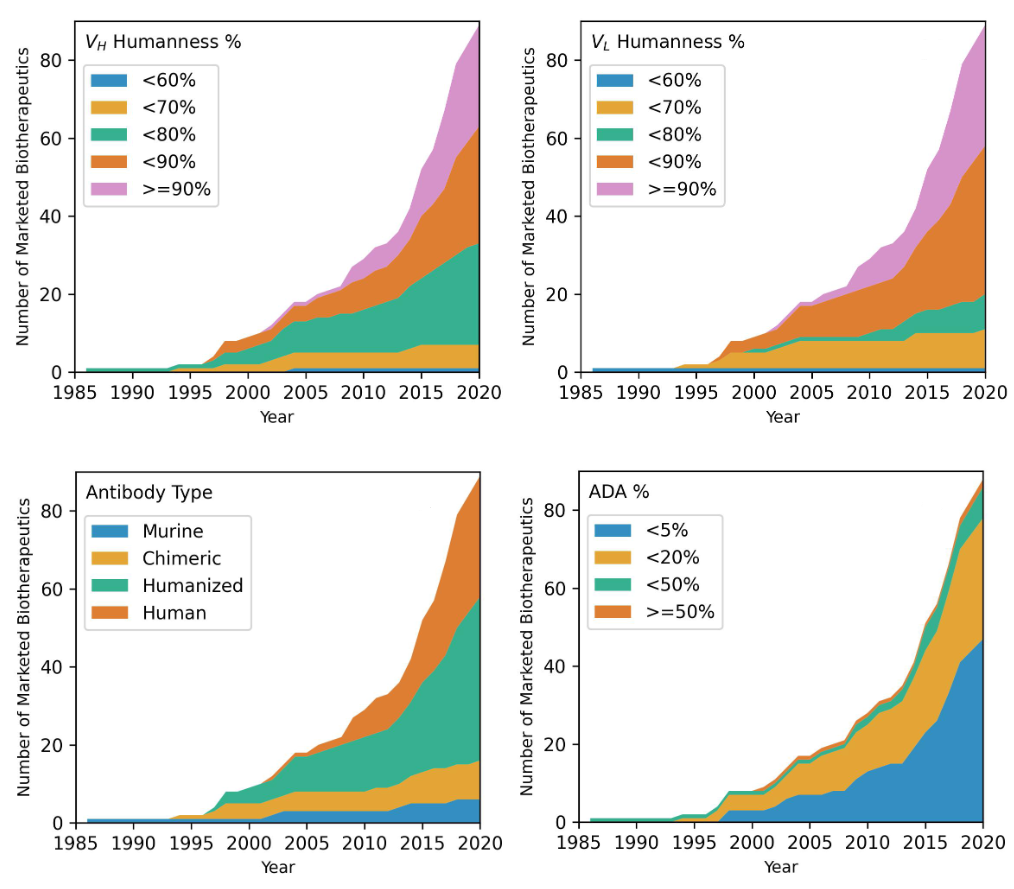
抗体药物可能引起免疫系统的抗抗体(ADA)反应,这对PK、疗效和药物安全性具有重要的潜在影响。近年来,ADAs发生率较低的抗体得到了更多的批准。1998年获批的曲妥珠单抗成为第一个ADA发生率低于1%的抗体药物。在所有统计的89个抗体药物中,ADA的平均报告发生率为11.3 ± 8.0%;其范围从bezlotoxumab的0%到alemtuzumab的62%。
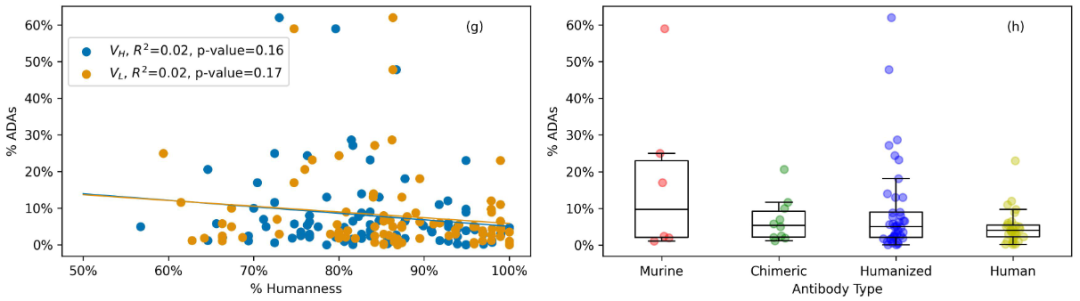
那么,抗体药物的人源化率是否与ADAs直接相关呢?对这89个抗体药物的分析显示,尽管观察到VH和VL随着人源化率的增加ADA都有微弱的下降趋势,但是其相关性在统计学上没有显著性差异。此外,从抗体类型上看,尽管再次观察到微弱的下降趋势,但ADA的中值没有显著降低。这些观察结果表明,抗体药物的免疫原性不仅仅取决于其人源化程度。
事实上,在接受免疫疗法的患者中产生免疫反应是一个非常复杂和多因素的过程。除了抗体的类型外,其他因素如分子序列特征、制造过程、制剂、在给药时已经存在的聚集体、给药途径以及患者的遗传和疾病史,都可能发挥重要作用。
产品形式、给药途径和给药频率
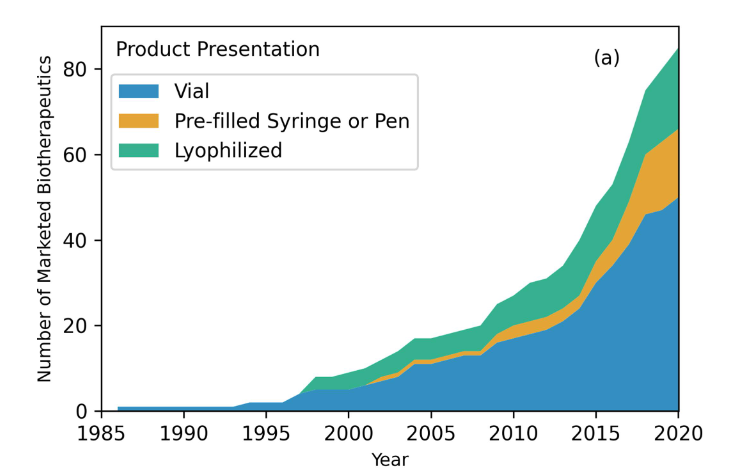
抗体药物的产品形式包括西林瓶、预先填充的注射器或注射笔以及冻干粉。关于产品形式的决策通常涉及到许多因素的考量,早期开发阶段稳定性研究中确定的API分子完整性(构象稳定性、聚集倾向,以及化学降解的影响,如氧化、脱酰胺和异构化)起着关键作用。多年来,西林瓶一直是市场上抗体药物最常见的产品形式,占到了55.2%。在其余产品形式中,冻干粉的形式占到22.9%,预填充注射器或注射笔占到21.9%。
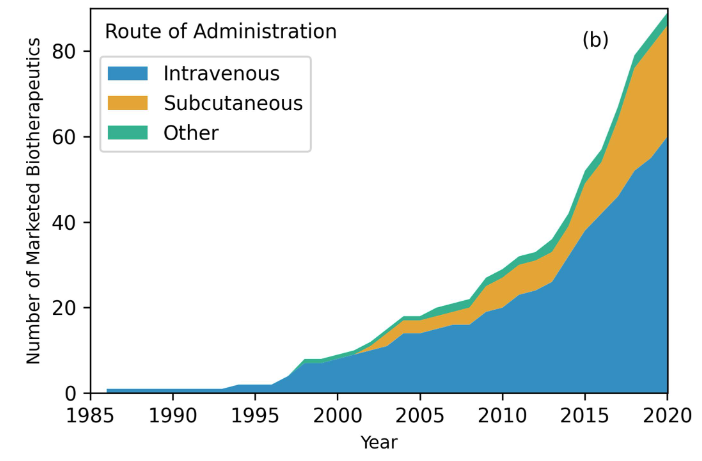
抗体药物的给药途径包括皮下、静脉注射和其它如皮内、玻璃体内等。在这89种抗体药物中,约三分之二(66.2%)是静脉注射,另有27种(30.4%)是皮下注射。在剩下的三种药物中,分别是皮内(racotumomab)、肌肉内(palvizumab)和玻璃体内(ranibizumab)给药途径。
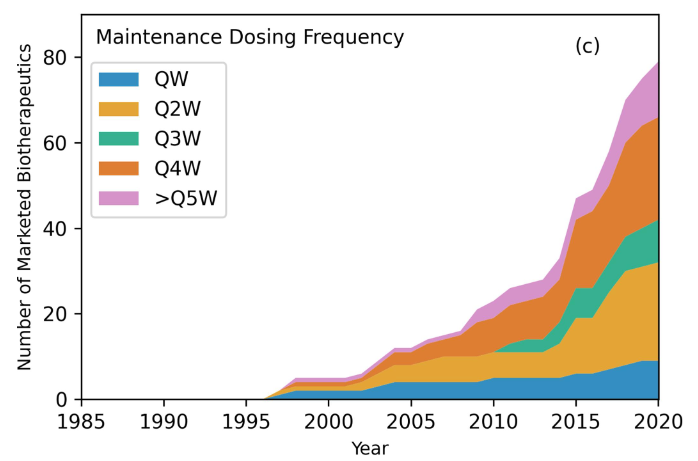
维持给药频率是指给患者服用维持剂量的频率。从患者便利性和医疗成本的角度来看,这是一个主要考量因素。在89种上市的抗体药物中,有70种需要定期维持剂量,其中6种提供了不止一种给药方案。因此,这70种抗体药物总共有79种给药方案。这79种给药方案中有9种为QW(11%),23种为Q2W(29%),10种为Q3W(14%),24种为Q4W(30%),13种≥Q5W(16%)。Q2W和Q4W是抗体药物最常见的给药方案。
抗体药物的PK数据包括清除率、消除半衰期和分布体积。下图显示部分抗体药物药代动力学随时间的变化趋势。
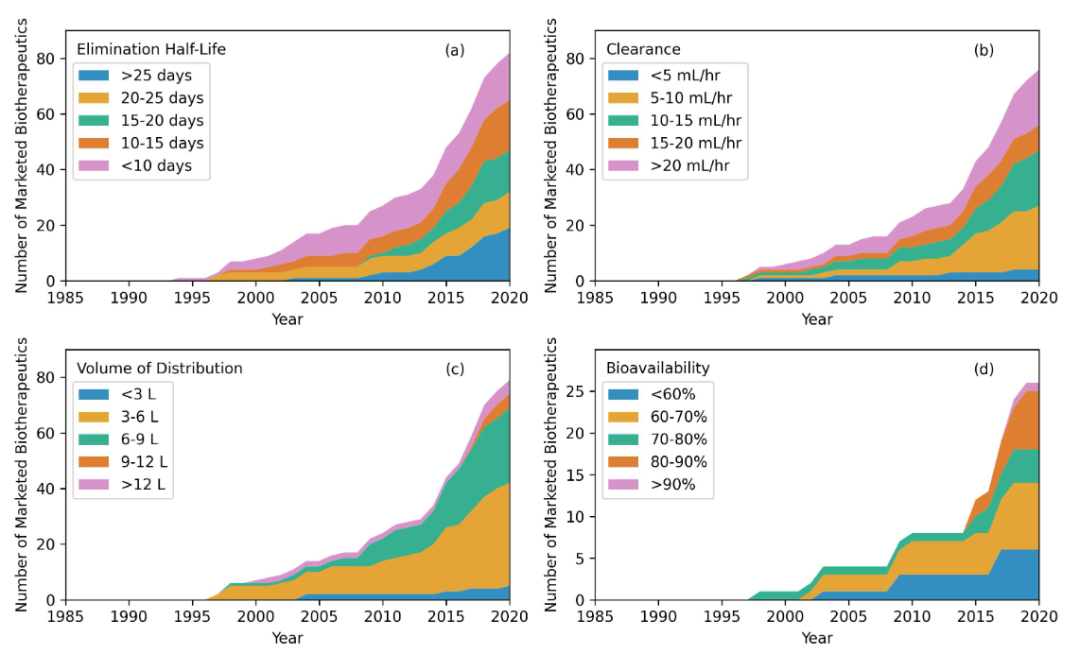
82种全长抗体的半衰期从17小时(sacituzumab goitecan)到50天不等(ravulizumab),平均值为14.5天;大多数上市的抗体药物在15至25天之间被清除。76种全长抗体清除值范围为0.46mL/小时(palivizumab)至350ml/小时(gemtuzumab ozogamicin),平均值为14.8 ml/小时。尽管范围很大,但73%的上市抗体药物的清除率<20mL/小时,62%的清除率<15ml/小时。79种抗体药物的分布体积范围从2.5升(cetuximab)到21.4升 (gemtuzumab ozogamicin),平均6.4L。另外,同时还观察了26种皮下注射产品的生物利用度随时间的变化趋势。2015年之前批准的此类产品的平均生物利用度为60%,从2015年到2020年,这一比例已增至74%。
制剂是生物药开发的一个重要方面,对稳定性、安全性、药理学以及给药途径都有重要影响。下图显示了四种常用非活性成分、缓冲液、稳定剂、张力调节剂和表面活性剂的时间变化图。在89种抗体药物中,87种使用缓冲液,35种使用张力调节剂,60种使用稳定剂,79种使用表面活性剂。
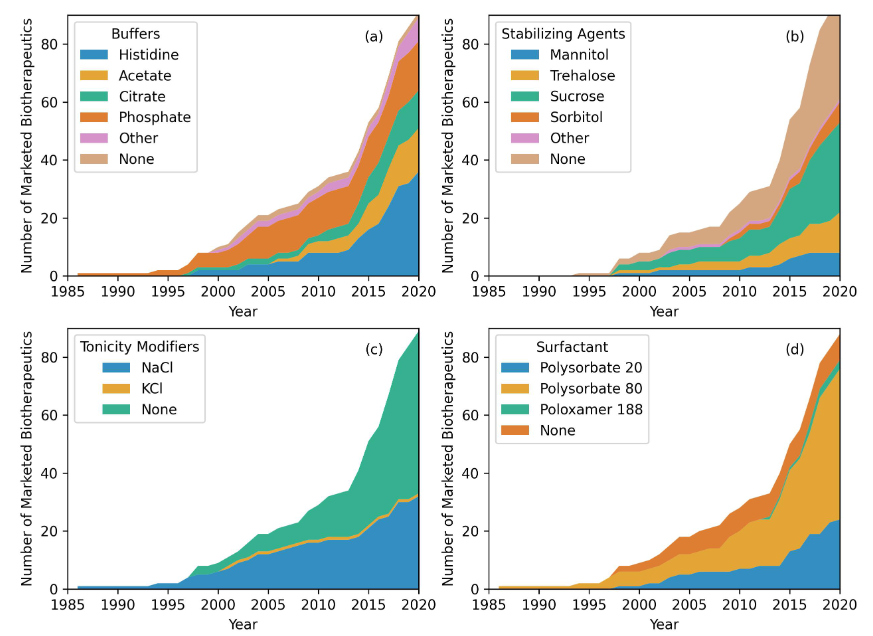
在87种含有缓冲液的制剂中,组氨酸是最常见的成分。与其他试剂相比,组氨酸具有更高的胶体稳定性。有36种(41%)上市抗体药物制剂中使用了组氨酸,平均浓度为3.0 mg/mL(范围为0.7–8.9 mg/mL)。2015年之前,最常用的4种制剂成分是组氨酸(34%)、磷酸盐(32%)、醋酸盐(13%)和柠檬酸盐(1.3%)。从2015年到2020年,排名前四的成分变为组氨酸(47%)、醋酸盐(21%)、柠檬酸盐(12%)和磷酸盐(9%)。这表明组氨酸和醋酸盐作为制剂成分的使用增加,而磷酸盐的使用减少。
在稳定剂的使用中,多年来,蔗糖一直是最常用的稳定剂。在含有稳定剂的60种制剂配方中,有36种(41%)上市抗体药物制剂中使用了蔗糖,平均浓度为91.9mg/mL(范围为4–822mg/mL)。2015年之前排名前四的稳定剂是蔗糖(50%)、海藻糖(27%)、甘露醇(13%)和山梨醇(9%)。从2015年到2020年,排名前四的稳定剂是蔗糖(54%)、海藻糖(20%)、山梨醇(14%)和甘露醇(11%)。因此,近年来蔗糖和山梨醇的使用有所增加,海藻糖和甘露醇的使用有所减少。
抗体药物制剂中张力调节剂的使用中,除了2001年批准的alemtuzumab使用了氯化钠(NaCl)和氯化钾(KCl),NaCl一直是市场上抗体药物制剂中唯一用作张力调节剂的盐。
表面活性剂用于抗体药物制剂中,以防止抗体在空气-水界面处的聚集和变性。在79种使用表面活性剂的制剂中,53种使用聚山梨醇酯80(67%),平均浓度为0.41mg/mL(范围为0.04–2.00mg/mL)。在抗体制剂中广泛使用聚山梨酯基非离子去涤剂作为表面活性剂。
抗体药物已经成为近几十年来最成功的生物药类型。抗体作为生物治疗药物的迅速崛起得益于抗体发现、制造、产品和临床开发以及药物递送方面的技术进步。通过分析已上市抗体药物的产业化趋势,我们可以观察到这种趋势背后的驱动因素。例如通过最大限度地减少副作用(如免疫原性)来提高安全性;通过CMC过程、药代动力学和给药频率的改进,增加开发的成功率;以及增加对患者便利性。所有这些驱动因素都是相互关联的,并将随着我们在抗体药物开发经验的增长,以及新的治疗概念、分子形式和制造技术的出现而继续发展。
参考文献:
1.Trends in industrialization of biotherapeutics: a survey of product characteristics of 89 antibody-based biotherapeutics. MAbs.2023 Jan-Dec;15(1):2191301.






