mRNA作为一种中间载体,能够将DNA中的遗传密码传递到核糖体中进行蛋白质表达,在疫苗、蛋白质替代治疗和基因编辑等方面具有巨大的潜力。与传统的小分子和蛋白药物相比,基于mRNA的疗法在安全性、效力和制备方面都显示出一些特定的优势。
然而,尽管mRNA具有这些潜在的优势,但如何安全高效且和稳定地进行细胞内递送仍然是mRNA的一个重要障碍。近年来,纳米生物技术取得了重大进展,为开发mRNA纳米载体提供了重要的工具。纳米载体系统可直接用于在生物微环境中装载、保护和释放mRNA,并可用于刺激mRNA翻译以制定更有效的干预策略。因此,设计新一代的纳米材料将可能引发了mRNA技术的革命。
脂质纳米颗粒是临床上最先进的mRNA载体。LNP为mRNA递送提供了许多好处,包括制剂简单、模块化、生物相容性和较大的mRNA有效载荷容量。除RNA药物外,LNP通常包括四种成分,可电离脂质、胆固醇、辅助磷脂和聚乙二醇化脂质,它们共同封装和保护脆弱的mRNA。
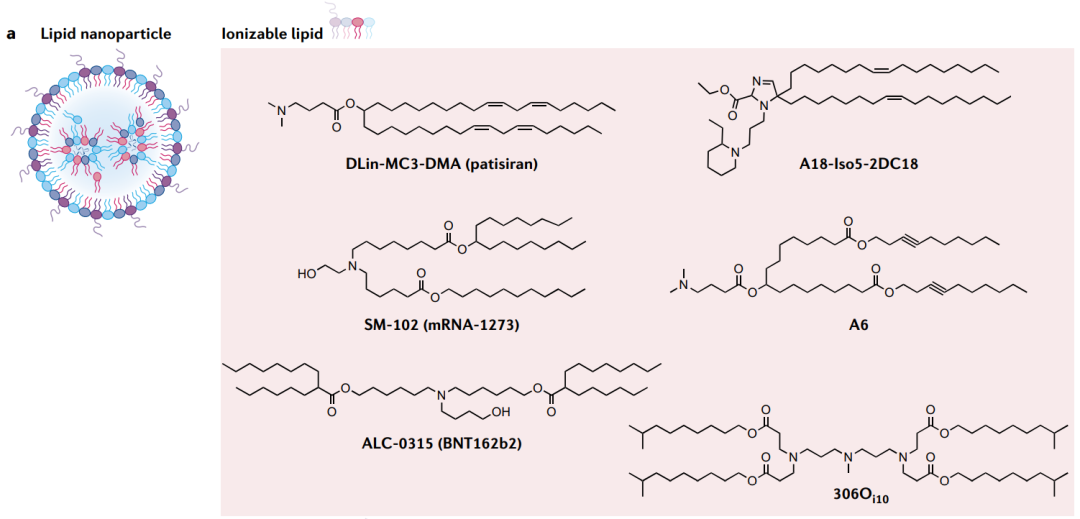
可电离脂质与mRNA在酸性缓冲液中形成纳米颗粒,使脂质带正电荷并吸引RNA。此外,它们在内涵体的酸性环境中带正电荷,这促进了它们与内涵体膜的融合,将其释放到细胞质中。
DODAP和DODMA是第一种用于RNA输送的可电离脂质。通过设计提高DODMA的功效,产生了DLin-MC3-DMA。这是第一个FDA批准的药物制剂中使用的可电离脂质:siRNA药物patisiran(Onpattro)。除了有效且安全地递送siRNA外,DLin-MC3-DMA还用于mRNA的递送。
目前,学术界和工业界的许多团体使用组合反应方案来合成潜在的传递材料,这种方法产生了许多有效的脂质,包括C12-200、503O13、306Oi10、OF-02、TT3、5A2-SC8、SM-102(用于抗SARS-CoV-2的Moderna疫苗mRNA-1273)和ALC-0315(用于辉瑞疫苗BNT162b2)。
除了寻求提高疗效外,人们越来越关注提高药物的特异性,特别是对疫苗和免疫疗法的特异性。含有多环金刚烷尾的脂质11-A-M58,和含有环咪唑头的脂质93-O17S59,已被设计用于体内靶向T细胞。尽管机制尚不清楚,但这些脂质的环状基团对于靶向T细胞至关重要。
尽管电离脂质可以说是LNP最重要的成分,但其他三种脂质成分(胆固醇、辅助脂质和聚乙二醇化脂质)也促进了纳米粒子的形成和功能。胆固醇是一种天然存在的脂质,它通过填充脂质之间的空隙来增强纳米颗粒的稳定性,并有助于在摄取到细胞的过程中与内涵体膜融合。
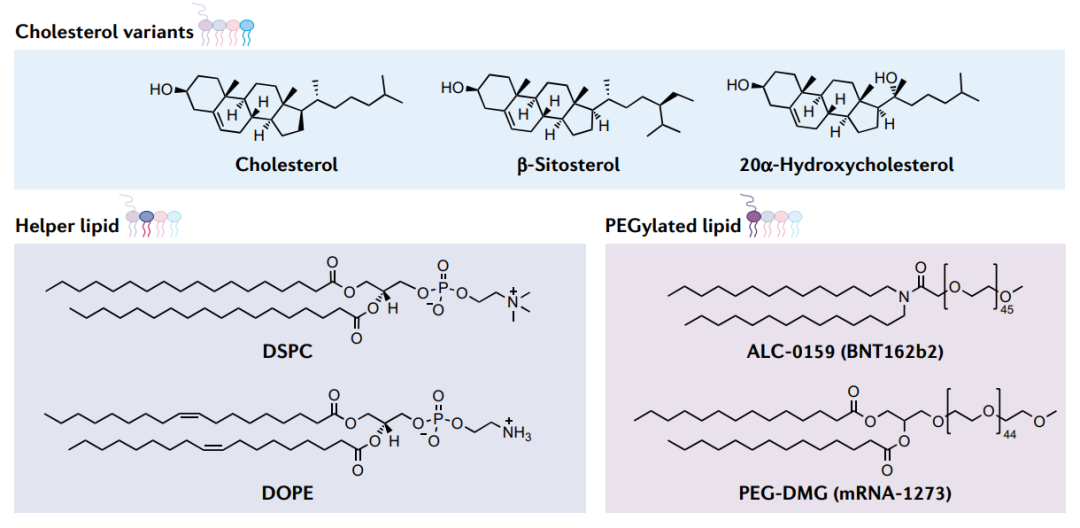
辅助脂质通过促进有助于膜与内涵体融合的脂质相变来调节纳米颗粒的流动性并增强功效。最佳辅助脂质的选择取决于可电离脂质材料和RNA载体。例如,对于类脂质材料,饱和辅助脂质(如DSPC)最适合传递短RNA(如siRNA),而不饱和脂质(如DOPE)最适合传递mRNA 。DSPC已被用于FDA批准的SARS-CoV-2疫苗mRNA-1273和BNT162b2中。
LNPs的聚乙二醇化脂质成分由聚乙二醇(PEG)与锚定脂质(如DMPE或DMG)结合而成。亲水性PEG可以稳定LNP,通过限制脂质融合调节纳米颗粒大小,并通过减少与巨噬细胞的非特异性相互作用增加纳米颗粒半衰期。mRNA-1273和BNT162b2 SARS-CoV-2疫苗均含有聚乙二醇化脂质。
尽管临床进展不如LNP,但聚合物具有与脂质相似的优势,能够有效传递mRNA。基于聚合物的递送系统由三种聚合物组成,包括阳离子聚合物、树枝状聚合物和多糖聚合物。阳离子聚合物将核酸浓缩成具有不同形状和大小的复合物,可通过内吞作用进入细胞。
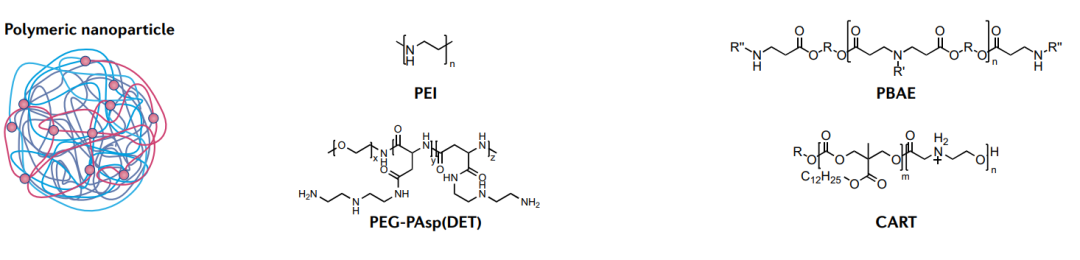
聚乙烯亚胺是研究最广泛的核酸传递聚合物。尽管其功效卓越,但由于其高电荷密度,其毒性限制了应用。此外,已经开发出几种毒性较小的可生物降解聚合物。例如,聚(β-氨基酯)在mRNA传递方面表现出色,尤其是对肺。
最近开发出了一种新型的含脂聚合物,称为电荷改变可释放转运体(CARTs),它能有效地靶向T细胞,操纵T细胞是非常困难的,因此,CART 是一种极具吸引力的传递材料,在mRNA疫苗和基因治疗领域具有巨大潜力。
脂质体多聚复合物(LPP)纳米递送平台是一种双层结构,以聚合物包裹的mRNA分子为核心,包裹在磷脂的双层外壳中。作为一种非病毒基因递送载体,LPP结合了聚合物和脂质体的优点,表现出优异的稳定性、降低的细胞毒性、高基因转染效率以及随着聚合物降解而逐渐释放mRNA分子的能力。
病毒样纳米颗粒(VLP)递送系统是病毒载体和非病毒载体之间的中间体。这些颗粒含有病毒载体的大部分成分,如包膜和衣壳,但没有病毒基因组。通过病毒工程技术,可以使mRNA结构和病毒衣壳结构蛋白之间特异性识别,从而形成VLP‐mRNA。VLP‐mRNA可以在病毒衣壳和mRNA自身瞬时表达的帮助下有效感染细胞。研究表明,与长时间表达Cas9的病毒系统相比,由VLP‐mRNA递送的Cas9 mRNA只能存在72小时。因此,脱靶效应的影响可以显著减少。
Cas9 mRNA的VLP递送已成功开发出靶向VEGFa,并在年龄相关性黄斑变性小鼠模型中将新生血管面积减少63%。测序结果表明,VLP‐mRNA不会诱导脱靶效应。这些实验结果有力地支持了VLP在提供CRISPR基因治疗方面的临床应用潜力。
细胞膜包被载体可以模拟细胞膜的性质,将天然细胞膜的特性与纳米材料的特性相结合,从而显著提高生物相容性,同时实现体内长循环和靶向递送。利用免疫细胞膜,如白细胞、巨噬细胞、中性粒细胞等,已经开发出一系列纳米药物载体。此外,肿瘤细胞和细菌也可以用来制备细胞膜伪装的纳米载体。考虑到肿瘤细胞和细菌表面的特异性蛋白可以激活免疫系统并提高粘附力,这些新型药物载体在mRNA药物的功能递送方面比传统的纳米载体更加多样化。另外,利用细胞膜上的特异性识别蛋白可以实现靶向药物递送到病变部位,为显著提高治疗效果提供了一种新的策略。
作为递送载体的无机纳米材料具有独特的物理化学性质,如优异的储存稳定性、良好的生物相容性和易于制备,使其成为mRNA递送的理想平台。目前,无机纳米结构,包括量子点、二氧化硅纳米颗粒(SNPs)、金纳米颗粒(AuNP)以及碳基和磁性氧化铁纳米结构,是纳米医学领域最受欢迎的类型。
AuNPs在递送核酸药物方面表现出独特的特性。通过共价或非共价结合,功能部分,如核酸药物和靶向配体,可以通过硫醇部分共价连接到金纳米颗粒核心。AuNPs由于其可调节的尺寸、简单的功能化、无毒性和免疫惰性,有望成为mRNA递送的有吸引力的支架。研究显示,编码促凋亡因子Bcl-2相关X蛋白的mRNA被AuNPs包裹,显示出高效的mRNA递送和抑制异种移植物肿瘤的效力。
然而,无机纳米材料在生物体内的长期非特异性积累可能会导致毒性,从而阻碍其大规模临床应用,因此需要进行详细的毒理学评估。此外,开发可生物降解和可清除的无机纳米材料至关重要。
外泌体是由多泡内小体(MVBs)成熟过程中形成的管腔内小泡(ILV)。当MVB与质膜融合时,ILV被释放到周质空间,称为外泌体。外泌体含有大量的特异性蛋白质、脂质、DNA、mRNA、非编码微小RNA和酶,这是一种新的细胞间通讯模式。因此,外泌体可以作为信使mRNA递送系统发挥作用。
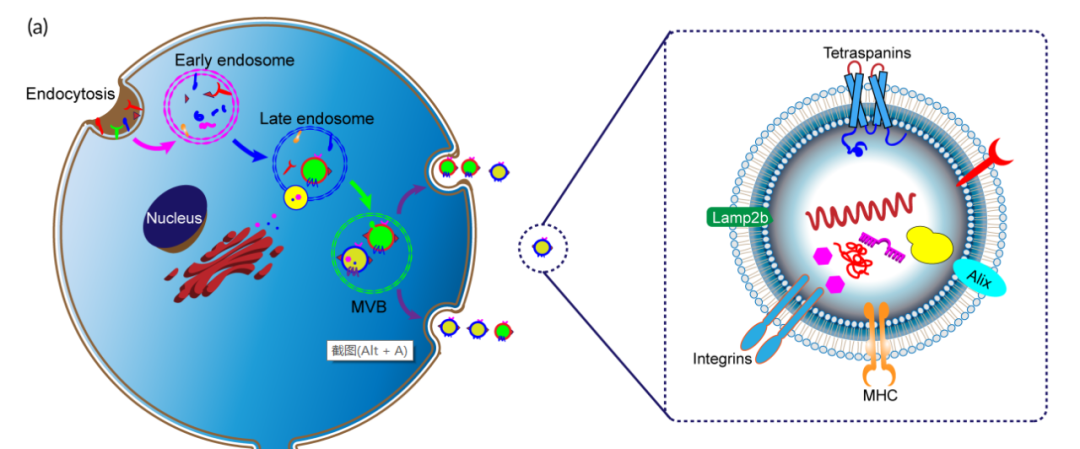
与合成的纳米颗粒相比,天然外泌体具有优异的生物相容性和低免疫原性等优异特性。此外,由于外泌体的体积较小,它可以抑制单核吞噬细胞的清除,并在实体瘤部位具有高渗透性和滞留作用,可以在靶点实现药物积累。外泌体本身可以通过血脑屏障,将药物输送到大脑中。特别是鼻内给药可以促进药物快速到达脑部病变,为脑部疾病的无创治疗提供了可能。
外泌体作为mRNA疫苗的载体越来越受到关注,特别是针对肿瘤的mRNA疫苗,其表面含有MHC的DC衍生细胞外囊泡可增强患者的T细胞免疫应答。此外,与LNPs相比,无论在体内外,外泌体在任何剂量下均无副作用。外泌体将功能性mRNA输送至人类细胞,也显示出比LNPs更好的性能。
除了作为mRNA药物载体外,外泌体的表面功能化还可以实现靶向给药。修饰的外泌体可以精确地将mRNA分子递送到靶细胞或器官。总的来说,外泌体具有高度的生物相容性,具有巨大的临床应用潜力,为mRNA药物传递开辟了新的途径。
参考文献:
1. Nanomaterials formRNA‐based therapeutics: Challenges and opportunities. Bioeng Transl Med. 2023 May; 8(3): e10492.
2. mRNA vaccines for infectious diseases: principles, delivery and clinical translation. Nat RevDrug Discov. 2021 Aug 25 : 1–22.
3. Recent advances in mRNA vaccine technology. Curr Opin Immunol. 2020 Aug;65:14-20.






