几十年来,临床前毒理学基本上是一门描述性学科,在该学科中,会详细分析与治疗相关的影响因素,并用作计算候选药物临床安全剂量范围的基础。然而,近年来,技术进步越来越多地使研究人员能够深入了解毒性机制,不断改善毒理学研究中的新工具和策略,以减少药物开发中与安全相关的损耗。至关重要的是,毒理学在发现阶段的目标不仅仅是简单的“前负荷”消耗,而是通过优化药物设计和选择的安全性维度来增加药物临床成功的可能性。
药物毒理学研究成功的关键是将安全性数据与其他特定分子特征有效结合,例如吸收、分布、代谢和排泄(ADME)以及理化特性,从而解决潜在靶点和潜在先导药物的固有风险。这涉及到一种模式的转变,即从使用经典的体内毒理学方法转向可转化的机制性体外试验,该试验可作为体内研究的可靠预测替代物。近年来,人们在诸如诱导多能干细胞(iPSC)、3D组织模型、微物理系统(MPS)和成像技术等领域取得了重大创新性进展,这些领域有可能大大提高毒理学研究分析的预测价值。
毒理学研究可大致分为两种方法:在化合物进行非临床体内或临床试验之前预测潜在毒性(前瞻性方法),或提供对非临床体内和临床毒性结果的机制理解(回顾性方法)。
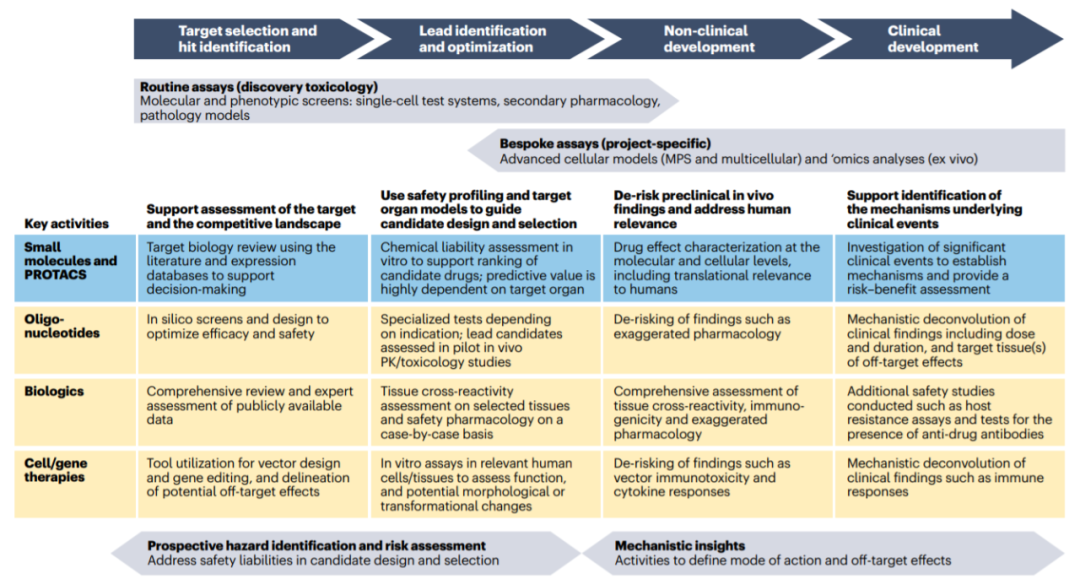
些方法有两个主要目标:在药物发现阶段,目的是指导确定最有前途的候选药物(即提供最佳治疗指标的安全候选药物),并尽早排除选择毒性最强的候选药物。在临床前和临床开发阶段,目的是提供机制安全性数据,从而能够做出良好的风险评估和管理,以支持临床试验设计。
在传统的毒理学评估方法中,一些毒理学发现可能归因于药物的主要靶点介导的效应。在过去的十年中,传统的毒理学分析已经扩展到考量靶标在健康和疾病中更广泛的生理作用。例如,靶标的主要功能以及上游和下游信号通路、相关靶标(直系同源和旁系同源)、跨物种靶标同源性分析、跨物种的功能和组织表达,以及动物对靶标基因修饰的表型后果。
彻底的靶标安全性评估有助于选择最合适的临床前安全性研究物种。它还可以识别需要纳入研究的潜在受影响的靶器官和组织,以及用于监测药效学反应发生和程度的生物标志物。最终,靶标安全评估可能决定研究的继续或中止决策,以及在项目进一步进行时量化风险的实验计划。
例如,哺乳动物的天冬氨酸蛋白酶家族是一个重要的药物靶标。然而,对某些天冬氨酸蛋白酶的选择性不足可能会阻碍安全有效治疗的发展。其中,组织蛋白酶D和E可能是最具毒理学相关性的。据报道,人类组织蛋白酶D缺乏是先天性人类神经元类蜡状脂褐质病的原因,其特征是神经变性、发育退化、视力丧失、癫痫和脂褐素的过度组织积累而导致的过早死亡。组织蛋白酶D的脱靶抑制是此类药物眼部毒性的主要驱动因素。这个例子说明了在为天冬氨酸蛋白酶等家族靶点开发药物时,需要彻底评估抑制密切相关靶点的风险。
使用体外细胞模型,可以以不同的置信水平来预测和/或理解器官特异性药物毒性。然而,体外细胞毒性和器官功能改变之间不一定具有必然联系,因此人们开发了更复杂的模型来评估化合物诱导的细胞功能扰动,从而提供特定组织和器官不良影响的潜在信息。
最初,人们侧重于测量简单的终点,例如通过ATP含量测量细胞存活率或器官衍生细胞系中的其他细胞毒性终点,这些方法可接受高通量筛选(HTS),目前仍在工业中大量使用。最近,人们已经开发了2D和3D培养物以及微物理系统,试图通过结合多细胞组织、支架和基于细胞的机械因素来模拟微环境条件,例如源自iPSCs或扩展多能干细胞(ePSCs)的心肌细胞。
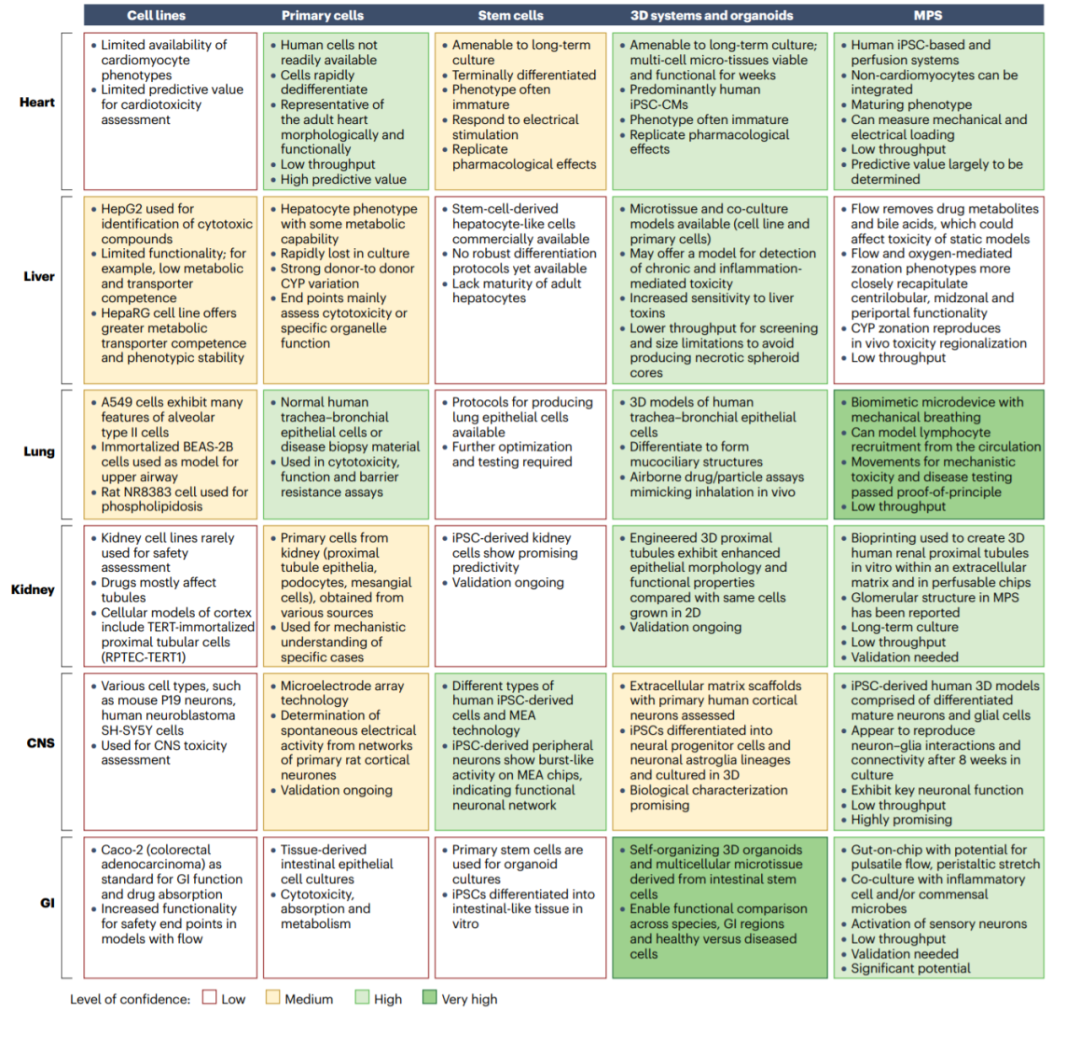
事实上,从简单细胞系到MPS,每一种体外靶器官方法都有内在的挑战和机遇,因此使用多种“恰当用途”的检测方法最能代表当前的实践。具有相对直接终点的简单细胞培养物可以为筛选和特定机制研究提供高通量和耐用的方法,但不需要反映体内情况所需的杂性;而关于复杂性可以用类器官或MPS补充,以提供深入的机制理解。
临床前研究阐明与人类的相关性
体外试验可能有助于了解各种动物研究中观察到的病理效应的分子和细胞机制,并阐明其与人类的潜在相关性。下面这个例子说明了在候选药物进入临床试验或上市过程中,对毒性作用机制理解的影响。
药物诱导的肿瘤变化是体内安全性研究中的一个常见情况,尤其是在啮齿类动物中。例如,改变的肝细胞病灶被认为是可能的肿瘤前病变,可自发发生或由化学物质或药物诱导。但在致癌性研究中,啮齿类动物病灶的增加并不一定会导致肿瘤。已经发现一种烟碱α7受体部分激动剂候选药物RG3487的非遗传毒性可诱导大鼠肝细胞改变,进而诱发肿瘤,这可能妨碍人类临床研究。
然而,在大鼠中观察到的肝细胞改变在小鼠或狗的肝脏中并没有看到。为了评估人类相关性,使用啮齿类动物、犬和人类干细胞以及患者衍生的3D细胞模型表型分析来探索致瘤的潜在机制。发现啮齿类动物表型模型表现出体内效应,而人类和犬类模型明显显示出无效应,研究表明药物诱导的效应使啮齿类动物核受体驱动的肝脏增殖,但与人类模型无关。这些数据支持RG3487进入临床试验。这个案例的数据突出显示了在分子和表型水平上使用跨物种体外模型进行人类毒理学研究的重要性。
识别临床事件的潜在机制
在评估临床开发或批准后出现的安全问题时,毒理学研究也至关重要。这种支持不仅限于母体药物,也可能包括药物杂质、降解物和代谢物。
例如,在用重组人促红细胞生成素(rhEPO)治疗的贫血患者中,由rhEPO的聚集形式产生的免疫原性后果可能导致纯红细胞再生障碍(PRCA),因此了解蛋白质聚集的潜在原因对于安全使用rhEPO至关重要。T细胞试验证实了与一例抗体介导的PRCA相关的临床批次中钨诱导的rhEPO聚集体的免疫原性,这一发现作为根本原因分析的一部分有助于获得监管批准。因此,产品最终修改了注射器的生产模式,以避免钨污染的可能性。
临床试验不良事件的事后调查并不总能挽救产品,但可能为后续候选药物提供解决方案。例如,在抗CD40L抗体因意外血栓并发症而终止用于治疗自身免疫性疾病的临床开发后,使用血管芯片模型的研究揭示了血栓前效应的机制。用不与人血小板上FcγRIIa受体结合的Fc结构域修饰后续抗体可减轻血栓前效应。
毒理学研究方面的重大创新
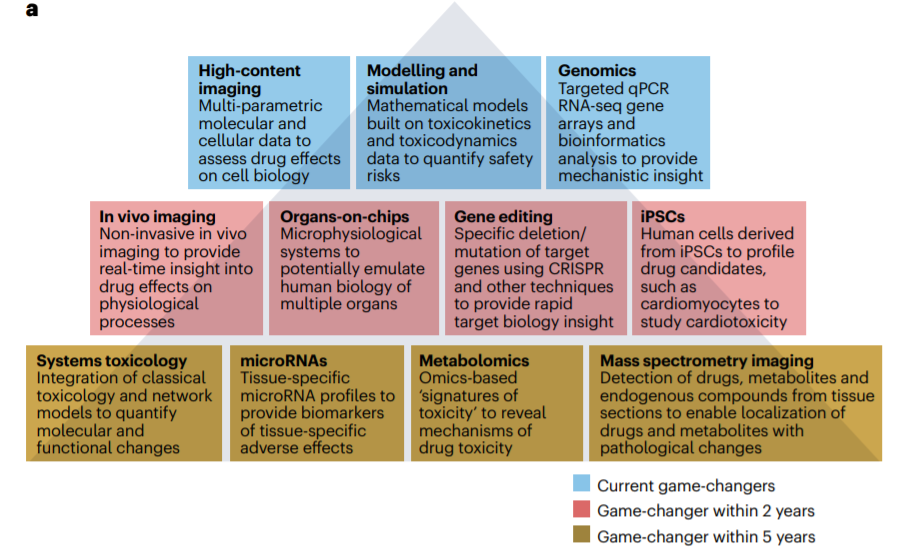
成像技术
药物对细胞和组织影响的空间分辨率提供了对药物毒性的宝贵见解;此外,多参数成像生物标志物为机理理解提供了基础。体外和体内成像技术已经取得了重大进展和应用,包括高内涵成像(HCI)、荧光和生物发光成像、MRI、CT以及使用MSI对细胞和组织样本进行的高维分子谱分析。
组学技术
毒理基因组学(TGx),即通过转录组学或基因表达的细胞输出(即蛋白质组学和代谢组学)对毒理学效应进行分子评估。这些技术可以大大加强临床前毒理学研究。
在药物早期发现过程中对化合物进行优先排序的转录谱分析是制药行业的一种常见方法。化合物的基因表达特征可用于捕获一系列多药理作用,并可用于监测药物化学优化的影响。此外,它还可以用来推测分析什么样的化合物子结构对给定的效果负责,并最终支持药物化学家设计新的合成结构。最近,基于转录组和药物诱导基因组效应分析方法已被证明可以解释肝毒性的机制,并使用基因网络模块关联预测不同的毒性表型。
预测药物毒性的计算和建模
多个测试平台的集成会产生大量数据集,需要使用高性能计算和基于机器学习的建模,以充分实现机制分析或做出有效预测。在某些特定情况下,基于体外测定数据的模型在预测人体毒性方面可能比动物毒性研究表现更好。
此类方法的一个主要例子是预测肿瘤药物的骨髓抑制,这在过去常常是一种剂量限制性毒性。为了预测和更好地告知给药后骨髓抑制的时间过程,已经构建了半生理学数学模型。这些模型不仅可以预测新型药物引起的骨髓抑制的程度,还可以预测它们如何与骨髓抑制标准护理疗法相互作用。这使得最有利的肿瘤候选药物能够被优先考虑,并且还可以通过联合剂量研究的探索来指导临床使用。
iPSC和先进的细胞模型
为了生成更多与转化相关的数据,毒理学家越来越多地使用复杂的人类和动物MPS模型来深入了解器官特异性和器官间毒性概况。
iPSC衍生心肌细胞(iPSC CM)是制药行业中用于评估心脏毒性和心脏电生理的最先进的iPSC衍生模型。3D肝细胞培养系统的进展导致了生理组织和器官水平功能的进一步改善。此外,基于原代肝细胞以及非实质细胞和免疫细胞的肝MPS有可能模拟供体的遗传、生理和疾病环境,并复制特定环境的毒理学。
此外,在其他MPS组织模型上也取得了实质性进展,包括胃肠道、肺和肾。这些模型仍然需要开发和验证,以适合用于药物发现和安全性测试。
基因编辑
CRISPR–Cas9等基因编辑平台的开发使研究人员能够深入了解单基因产物对疾病的贡献。当专注于了解毒性的特定生物学机制或不良结果途径时,具有准确和特异性删除或修饰特定基因的能力也可以深入了解药物靶点的潜在安全性。
药物毒理学是根据药物的理化特性, 运用毒理学的原理和方法, 对药物进行全面系统的安全性评价并阐明其毒性作用机制。其主要目的在于指导临床合理用药, 降低药物不良反应及减少因药物毒性导致的新药开发失败。近年来, 随着各种前沿学科及相关技术的飞速发展,赋予了药物毒理学新的发展契机。
特别是近些年,药物毒理学研究模式也正在发生巨大变革,以满足药物研发中提早决策, 缩短新药开发时间和降低成本的实际需要,并在最可能导致新药开发失败的毒性问题研究过程中促进制药企业、学术界和监管部门的紧密协作。
参考文献:
1.The evolving role of investigative toxicology in the pharmaceutical industry. Nat Rev Drug Discov.2023 Feb 13;1-19.






