基于杆状病毒的表达系统
杆状病毒表达系统是基于感染的系统。它非常适合更大体积的规模放大,并利用非哺乳动物的昆虫细胞,例如可以在无血清培养基中悬浮生长的草地贪夜蛾 (Sf9)。此外,杆状病毒本身具有与 rAAV 复制所需的腺病毒辅助功能等效的辅助功能。第1个表达系统是由 Urabe 等人开发的 Three-Bac 系统(图 3A)。在该系统中,Sf9 细胞被3种不同的杆状病毒感染:Bac-Rep,在来自 Orgyia pseudotsugata 核型多角体病毒的截短早期启动子 E1(Δ1E1)的控制下表达 Rep78,以及在杆状病毒 p10 启动子控制下表达 Rep52;Bac-VP,在晚期多角体 (polh) 启动子下表达衣壳蛋白(VP1、VP2 和 VP3),由于 Sf9 的剪接机制低效,剪接内含子被去除;和 Bac-GFP,表达侧翼为 AAV 反向末端重复 (ITR) 元件的目的基因。为了确保在 Sf9 细胞中产生 AAV 衣壳,其化学计量比与哺乳动物细胞生产的相似,VP1 基因的起始密码子 ATG 突变为 ACG,以削弱 Sf9 细胞中 VP1 的表达。在这项研究中,昆虫细胞中生产的 AAV 载体与哺乳动物细胞中生产的 AAV 载体具有相似的物理和生化特性。病毒滴度产量达到 5×104 vg/cell。因此,1 L Sf9 细胞培养液相当于 500 至 1000 个 HEK293 T-175 摇瓶。尽管有这些有希望的结果,但第一代杆状病毒系统有一个主要缺点:由于 rep52 和 rep78 之间的同源重组事件导致 Bac-Rep 的不稳定性,因为它们共享相同的重叠序列。这表现为传代几代后滴度下降。此外,对 rAAV 感染性至关重要的 VP1 蛋白的表达水平不足。
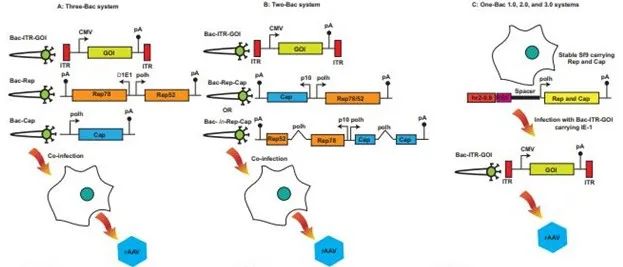
图3. 基于Sf9的rAAV生产平台。用于AAV生产的主要Sf9系统从Three – Bac系统 (A) 开始。之后,为了解决Three - Bac系统的稳定性问题,引入了一些改进,从而产生了Two-Bac (B) 和One-Bac版本 (C)。这些改进提高了rAAV的产量,优化了衣壳蛋白质的化学计量学。pA,聚腺苷酸化信号;曲线表示合成内含子在结构中的位置。
A) Three-Bac系统:优势:1. 易于规模放大;2. 与传统三质粒转染相比,rAAV产量较高。挑战:1. 由于两个Rep基因之间的同源重组,在几个传代之后Rep表达丢失以及rAAV 产量降低;2. rAAV病毒蛋白表达不理想。
B)Two-Bac系统:优势:1. 易于大体积规模放大,常用于工业应用;2. 与传统三质粒转染相比,AAV产量较高;3. Rep-Cap基因盒在传代后的稳定性更好。挑战:1. rAAV病毒蛋白表达不理想;2. 重组杆状病毒构建的时间较长。
C)One-Bac系统:优势:1. 易于大体积规模放大,常用于工业应用。2. 与传统三质粒转染相比,AAV产量较高;3. 通过去除RBE以及引入合成内含子,在2.0版本中引入了多个改进,在3.0版本中,在Kozak序列中引入了更多的优化,以提高VP1表达。挑战:1.创建稳健Sf9和工程设计重组杆状病毒的时间较长。
为了克服 Three-Bac 系统的挑战,几个研究小组尝试使用2种不同的方法解决不稳定性问题,并改善 VP1 表达。首先,Rep 和 Cap 载体被进一步修改,以生成一个 Two-Bac 系统(图 3B),如 Smith 等人所述。Rep78 和 Rep52 通过“泄漏扫描机制”从单个 mRNA 中表达,没有重复在杆状病毒多角体启动子控制下的rep编码序列。此外,将 Rep78 的起始密码子突变为弱翻译起始密码子 CTG,并通过将接下来的 9 个框内 ATG 更改为非起始密码子,同时将 Rep52 起始密码子保留为 ATG进行密码子优化。遇到次优的翻译起始信号时,一部分核糖体亚基在该位点开始翻译,而剩余的 40S 亚基继续寻找下一个翻译起始位点。这导致全长 Rep78 和 Rep52 的截短蛋白质序列的表达。在 cap 基因的情况下,其表达由具有起始密码子 ACG 的杆状病毒 p10 启动子驱动。rep 和 cap 基因在一个杆状病毒构建体中以头对头的方向放置,而第2个病毒携带两侧为ITR的转基因。病毒滴度产量达到 7×10^4 vg/cell,但 VP1 的表达水平仍低于瞬时转染系统产生的表达水平。
在第2种方法中,Chen 将携带多角体启动子的人工内含子引入 p19 启动子区域的 rep78 编码序列中,以允许从单个编码序列表达 Rep78 和 Rep52,这破坏了 Rep78/52 之间的同源区域,而Three-Bac系统保持原样(图3B)。类似地,将具有多角体启动子的内含子引入衣壳编码序列,以削弱VP1蛋白表达,同时保持瞬时转染系统产生的化学计量。此外,VP1 的起始密码子保留为 ATG,与具有 ACG 起始密码子的情况相比,这导致 rAAV 产品的感染性高出2倍。研究观察到 rAAV 血清型 1、2、6 和 8 的滴度有所提高,产量范围为 3.53 × 10^13 至 1.58 × 10^14 vg/L 培养液(图 3B)。
通过简单地设计单杆状病毒系统,对 Two-Bac 系统进行了进一步改进,这是 Mono-Bac 系统的基础,其中一个杆状病毒在晚期多角体和 p10 启动子控制下携带所有必要的 rep 和 cap 基因 (Bac-rep-cap)。该盒通过同源重组整合到杆状病毒基因组非必要的 egt(蜕化类固醇 UDP-葡糖基转移酶)基因座中,而侧翼为 ITR 的转基因通过 Tn7 转座酶转座到 attTn7 位点。
One-Bac 系统由 Aslanidi 等人引入(图 3C)。在该系统中,通过稳定整合 rep 和 cap 基因,制备了生产 Sf9 细胞系,每个基因均由多角体启动子和增强子元件 hr2-0.9 控制。生产 Sf9 中使用的 rep 和 cap 基因盒以相同的方式构建,其中每个包含增强子元件 hr2-0.9,然后是 AAV rep 结合元件 (RBE)、填充序列和控制表达的多角体启动子。在生产 Sf9 中,rep 和 cap 基因的表达保持沉默,直到细胞被携带转基因的杆状病毒感染,后者侧翼为反向末端重复序列和与 hr2-0.9 结合的立即-早期 (IE-1) 转录反式调节子目标序列。反式调节子与hr2-0.9 的结合诱导rep 和cap 表达和扩增。与原始杆状病毒系统相比,这导致每个细胞多达 1200 个拷贝,并且 rAAV 产量增加了 10 倍。
Mietzsch 等人将 One-Bac 系统进一步发展为第二代 One-Bac 2.0。其中 RBE 从 rep 和 cap 基因盒中移除(图 3C)。这种修改导致了一个仍然有功能的系统,整合的 rep 和 cap 基因的扩增较少,并且这些基因较少被包裹至最终的 rAAV 生产中。通过切换到 VP1 (ATG) 而不是 (ACG) 的原始起始密码子,并将内含子插入到含有多角体启动子的 cap 基因中,对该系统进行了更多的修改。这些修改导致 VP1 表达增加,与使用原始 One-Bac 系统产生的 AAV5 相比,AAV5 载体的感染性增加,且前者显示出较低水平的 VP1 表达。第三代 One-Bac 3.0 通过对翻译起始密码子和 Kozak 序列的其它修饰,进一步优化了 VP 的化学计量(图 3C)。这使 AAV5 和 AAV9 中 VP1 表达水平达到最佳,具有高感染性。One-Bac 系统所依赖的稳定 Sf9 细胞的生成在昆虫细胞中更具技术挑战性。因此,常用的系统是 Two-Bac,它结合了 One-Bac 或 Mono-Bac 的简单性,以及相比 Three-Bac 的相对稳定性。
最近,从亲本 Sf9 细胞制备了一个高产克隆 ExpiSf9,并评估了3种 rAAV 血清型的生产。与亲本 Sf9 相比,该克隆细胞系的 AAV9、AAV2 和 AAV8 产量分别提高了 7、15 和 19 倍。另一方面,由于固有的非最佳衣壳 VP1 比率,昆虫细胞产生的 AAV9 的体内转导效率低于哺乳动物产生的 AAV9 的结果。
尽管最近有所改进,但杆状病毒系统仍然存在一些限制。VP1、VP2 和 VP3 的杆状病毒化学计量比仍然不同于哺乳动物产生的 rAAV,需要做更多的工作来确定 rAAV 生产所需的基本杆状病毒辅助基因。此外,哺乳动物和昆虫细胞之间衣壳蛋白翻译后修饰特性的差异、它们对 rAAV 感染性的负面影响、维持杆状病毒的长期储备供应、以及传代次数增加后的不稳定性问题都需要解决。
基于 HeLa 的表达系统
第一代 HeLa 源性稳定包装和生产细胞系由 Clark 等人开发。这些稳定细胞源自Hela细胞的质粒转染,后者包括 AAV2 的 rep-cap 基因以及含有药物选择标记的 rAAV 载体基因组。多个研究小组对该系统进行了进一步开发,以引入包含 AAV Rep 和 Cap 功能的包装细胞系,作为中间步骤。其它包装细胞系由 HeLa 细胞或 A549 细胞创建,其来源于未经病毒转化的人肺泡细胞癌。用于制备这些稳定包装细胞的细胞系缺乏腺病毒 E1A/E1B 基因,后者是反式激活 p5、p19 和 p40 以转录 rep 和 cap 基因所必需的。因此,它们必须首先感染提供这些功能基因的腺病毒 (E1A/E1B),然后感染 AAV-混合病毒 (Ad-AAV Hyb.virus),这是一种含有侧翼为ITR的 rAAV 转基因序列的腺病毒。使用复制缺陷型腺病毒可避免复制以及随后对最终 rAAV 产品的污染。已经开发了纯化方案,以在生产过程中去除腺病毒(图 4)。
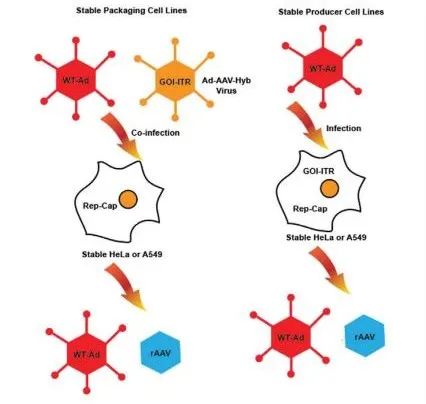
图4. 基于HeLa的rAAV生产平台。来自携带rep-cap基因的HeLa或A549的稳定细胞系被建立为包装细胞。细胞同时感染野生型腺病毒和腺病毒-AAV-Hyb病毒,其中侧翼为反向末端重复序列的转基因插入缺失的E1区。当转基因被稳定地整合到包装细胞系中时,生产细胞系就建立起来了。用野生型腺病毒感染生产细胞会产生rAAV。在这两个平台中,都需要一个清除步骤,来取出污染性野生型辅助病毒。
优势:1. 容易规模放大;2. rAAV产量提高。挑战:1. 针对每个特定项目制备Ad-AAV-Hyb病毒载体和稳定细胞系需要很长时间;2. 需要从产品批次中取出残留的腺病毒;3. 使用HeLa细胞系的安全性问题。
一种复制缺陷型腺病毒在 E2B 基因中具有温度敏感性突变,只允许病毒在允许的温度下复制。温度敏感突变体的缺点是它可恢复为野生型并且难以生产,随后无法轻松在大规模生产中实施。基于HeLa的稳定细胞系用于生产第一个用于治疗囊性纤维化临床试验的rAAV产品。该系统的主要优点是无需转染。rAAV 的生产依赖于用腺病毒感染细胞,如果有一个既定的方案可以从最终的 rAAV 产品中去除污染的腺病毒和病毒蛋白,该系统可以直接规模放大。该系统的缺点是建立稳定包装/生产细胞系所需的时间较长,以及腺病毒载体的 GMP 原液制备。此外,HeLa 细胞系的使用存在一些安全问题,因为已知它包含编码人乳头瘤病毒早期蛋白的几种致癌基因的多个拷贝。
基于 HSV 1 型的表达系统
单纯疱疹病毒 1 型 (HSV-1) 为 AAV 复制提供辅助功能,并且与腺病毒一样被广泛研究。与腺病毒相比,HSV-1 复制蛋白直接参与 rAAV 复制,它的基因组为 152 kb 的双链 DNA,编码超过 80 种蛋白质。基因组分为两部分,称为长独特序列 (UL) 和短独特序列 (US),侧翼为反向重复区域。
HSV-1 中诱导 AAV Rep 表达并随后导致其复制的必需基因被描述为 HSV-1 解旋酶-引物复合物 (HP) (UL5/UL8/UL52) 和单链 DNA 结合蛋白 ICP8 (基因 UL29)。其它对复制不是必需但据报道支持 AAV Rep 表达的辅助基因包括 ICP0(E3 泛素连接酶,HSV-1 基因表达的反式激活因子)、ICP4(一种主要的病毒转录因子)和 ICP22(转录调节因子)。此外,UL30 和 UL42 是 HSV-1 聚合酶催化亚基,可直接增强 AAV 基因组复制。尽管已证明4种 HSV-1 蛋白(UL5/UL8/UL52 和 ICP8)足以恢复 AAV DNA 复制,但与在所有 HSV-1 基因存在下观察到的相比,复制效率非常低。完全激活 rAAV 复制还需要其它未知的 HSV-1 因子。事实上,Meier 等人最近已经证明了这一点。HSV-1 支持的 rAAV 基因组复制使用滚环复制 (RCR) 机制,而不是腺病毒支持复制中的链置换滚动发夹复制 (RHR) 机制。
Conway等人报道了基于 HSV 扩增子系统的第一代 rAAV 生产方法。在该系统中,AAV2 rep 和 cap 盒被克隆到携带 HSV 复制起点和包装信号的质粒中。为了产生携带 AAV2 rep 和 cap 基因的 HSV 病毒,将该质粒转染到预感染野生型 HSV-1 的 Vero 细胞中,以产生携带 AAV2 rep 和 cap 基因的 HSV (HSV-RC)。辅助功能是从野生型 HSV-1 感染前以反式形式提供的。然后将产生的HSV-RC病毒用于感染携带整合rAAV盒的HEK293或用携带侧翼为AAV2 ITR的转基因的质粒转染,又或用rAAV2病毒感染。
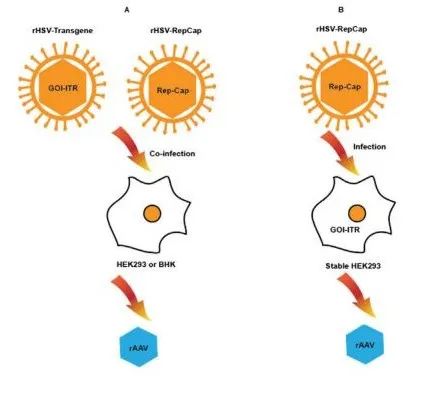
图 5. 基于 HSV-1 的 rAAV 生产平台。(A) 用2种复制缺陷重组疱疹病毒 (rHSV) 感染 HEK293 或小仓鼠肾 (BHK) 细胞,病毒携带转基因 GOI,其侧翼为 ITR 和 rep-cap 基因盒,实现 rAAV 生产。(B) 或者,如最近报道的,具有转基因 GOI 的稳定细胞系被携带 rep-cap 基因盒的单一病毒感染,这也可实现 rAAV 生产。
优势:1. 容易规模放大;2. rAAV产量提高;3. 使用单一rHSV感染的商品成本较低。挑战:1. 针对每个特定项目制备rHSV载体和稳定细胞系的时间较长。2. 需要从产品批次中去除残留的rHSV蛋白/DNA。
尽管这种方法可生产 rAAV,但产量很低,并且 HSV-RC 在几次传代后逐渐丢失。此外,除了细胞病变效应以及随后降低的 rAAV 产量外,出于安全考虑,使用野生型 HSV-1 是不可取的。去除上游工艺中产生的野生型或其它活病毒需要强大的纯化工艺步骤,这通常会导致显著的收率损失,并且还可能存在规模放大问题。同一研究小组对该方法进行了进一步改进,制备了具有 ICP27 编码基因 (UL54) 缺失的 HSV 突变体,这导致了观察到的细胞病变效应。这些变化显著降低了细胞毒性并增加了 rAAV 的产量。
Conway 等人还引入了第二代方法,其中扩增子被重组 HSV (rHSV) 感染取代(图 5A)。AAV-2 rep-cap 盒被插入胸苷激酶(TK ) 通过同源重组获得 ICP27 缺陷型 HSV 基因座并在 V27 细胞中繁殖,以产生 rHSV 病毒。V27 细胞是稳定携带 UL54 基因的 Vero 细胞的衍生物,该基因编码反式提供的 ICP27 蛋白,以产生 rHSV。在使用 rHSV 感染稳定携带 rAAV 转基因盒或用含有 rAAV 转基因盒的质粒转染或感染 rAAV 病毒的 HEK293 细胞后,这些改进提供了更高的 rAAV 产量。此外,细胞病变效应(ICP27 蛋白)被阻止,HSV-1 辅助功能和 rep-cap 基因都被传递到单个感染载体上。该系统是使用贴壁细胞开发的,并且仍然依赖于质粒的转染,这导致了一些限制。
该平台开发的下一步是摆脱贴壁细胞并实施无转染系统。Hwang等人使用 ICP27 缺陷型 HSV-1 生成两个携带转基因的 rHSV 载体,侧翼为 AAV2 ITR 和 AAV-rep-cap 盒(图 5A)。通过同源重组将盒插入胸苷激酶 (TK) 基因座。两种 rHSV 载体用于在培养瓶中共感染 HEK293 细胞。相对于 HEK293 细胞中的瞬时转染或单一 rHSV 感染,观察到 rAAV 产量显著增加。使用适合在悬浮无血清培养中生长的幼仓鼠肾细胞 (BHK) 可以降低感染复数 (MOI) 并规避 Rep 蛋白的轻微毒性。此外,与 HEK293 细胞相比,BHK 细胞具有生长快、感染性强的优势。这随后导致在共感染期间使用较低的 MOI。最近,两个小组通过比较 rHSV 和基于瞬时转染的贴壁及悬浮 HEK293 培养平台来研究 rAAV9 产品的产量和质量,并报告说这两种方法对于表达微肌营养不良蛋白的rAAV9的产量和效力相同。在悬浮 Expi293F 的情况下,rHSV 方法的产量和完整衣壳百分比更高,残留的宿主细胞蛋白和辅助 DNA 更少,同时相比瞬时转染悬浮培养,检测到更高的 HSV DNA。
Selvaraj等人介绍了对基于 rHSV 的方法的进一步改进,其中,以 HEK293 开发了一个稳定的细胞系,其携带一个侧翼为 AAV2 ITR 和选择标记的 rAAV 转基因(图 5B)。仅使用一个 rHSV-rep-cap病毒感染贴壁细胞,选择高 rAAV 生产细胞系后,他们在最后的纯化步骤中获得了 1-2×10^13 vg/6360 cm2 面积的高产量,且有50% 完整衣壳。这种方法可以适用于悬浮培养,以放大规模,并通过制造一种 rHSV-rep-cap 病毒而不是两种病毒来降低商品成本。在下游工艺中需要一个完善的清除方案,以去除最终 rAAV 中可能诱导宿主免疫反应的任何残留 HSV DNA 或蛋白质。
用于重组 AAV 生产的稳定细胞系开发
在 HEK293 细胞中产生稳定细胞系的挑战源于 E1A 的内源性表达,E1A 稳定整合到 HEK293 的基因组中。E1A 的表达可以反式激活 rep 和 cap 基因,也可以打开 E1B、E2A 和 E4 等辅助基因。Rep 的早期表达尤其具有细胞毒性,这使得获得稳定的细胞系非常具有挑战性。然而,稳定的细胞系对 AAV 的生产非常有利,因为它们具有多个优点,包括更好的可放大性、更少的批次间差异、更低的商品成本以及更高的产量。Yang 等人最先尝试了为 rAAV 生产创建稳定的 HEK293 细胞系。他们用诱导型启动子替换 p5 启动子,以及调节 Rep78/68 的表达。然而,小 Rep 蛋白 (Rep52/40) 的表达仍然来自嵌入在 rep 基因的重叠开放阅读框中的 p19 启动子,因此诱导型启动子不会导致 p5 和 p19 的时间协调表达。在 Qiao 等人的另一项研究中,他们通过在 HEK293 细胞系中设计双剪接开关机制,来控制4种稳定整合的细胞毒性 Rep 蛋白(Rep78、Rep68、Rep52 和 Rep40)的表达。在这个系统中,一个包含转录终止序列的内含子盒被插入到 Rep 蛋白的重叠编码序列中,以提前终止它们的表达,而不改变 P5 和 P19 启动子的活性。然后通过感染携带 Cre 重组酶 (Ad-Cre) 的有缺陷的腺病毒来恢复所有4种 Rep 蛋白的表达。尽管他们能够使用这种方法获得高滴度的 rAAV,但不利的方面是,rAAV 产品中可能存在有缺陷的 Ad-Cre 的痕量污染,这仍然存在很小的风险。
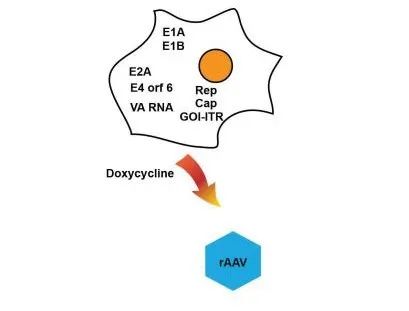
图6. 用于rAAV生产的稳定细胞系。用于AAV生产的稳定生产细胞系携带所有部件,包括Rep、Cap、 E2A、E4或f6、VA RNA和GOI-ITR。E1A和E1B均为内源性表达。加入强力霉素后诱导rAAV生产。
优势:1. 可规模放大;2. 无腺病毒;3. 可通过灌流工艺提高rAAV产量;4. 适用于药物开发的后期。挑战:1. 针对每个特定项目开发生产细胞系需要较长时间。
最近,研究已开发出了新的稳定 AAV 生产细胞系(图 6)。在该技术中,首先生成稳定表达 Rep 和必需辅助蛋白的包装细胞系,然后,通过将衣壳和转基因质粒整合到包装细胞系中,生成稳定生产细胞。使用多西环素诱导rAAV颗粒的表达。该系统为该领域提供了许多优势,例如消除了瞬时转染步骤,以及无腺病毒和可放大性。使用基于灌流生物反应器的优化工艺,可在粗收获液中获得 1×10^15 vg/L 的产量以及超过 30% 的 rAAV8 完整颗粒。






