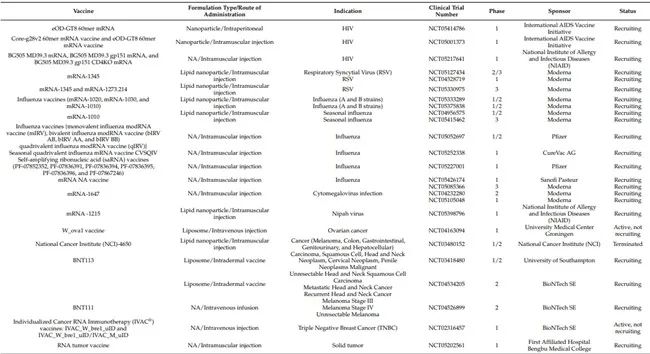
临床前研究成功后和上市前的任何候选疫苗的关键步骤是临床开发。任何 mRNA 疫苗的临床开发都包括一系列临床试验,以评估人体的安全性、免疫原性和有效性。根据患者人群和试验目标,它们被分为 1、2、3 和 4 期。1 期研究在一小群人(最好是一个中心)中进行,主要是为了确定该药物的安全性和药代动力学疫苗。2 期研究是概念验证研究,主要旨在确认 1 期研究中获得的结果,并评估在稍多人群中的疗效。3 期研究是在多个中心和广泛人群中进行的验证性研究,以确认候选疫苗的有效性和安全性。这些研究通常使用活性比较剂或安慰剂进行。4期研究在候选疫苗获批上市后进行,主要目的是确认疫苗的安全性。每种候选疫苗在商业上市前都应在所有临床研究中进行关键的临床评估。疫苗的开发需要几年时间才能完成。然而,由于 COVID-19 大流行,Comirnaty(辉瑞)和 Spikevax(Moderna)在不到一年的时间内获得了紧急使用授权(EUA)。目前,鉴于 mRNA 的能力,临床试验中有多种 mRNA 疫苗用于传染病(COVID-19、流感、寨卡病毒、尼帕病毒、呼吸道合胞病毒等)、遗传疾病和肿瘤适应性以及先天性免疫反应的疫苗。这些疫苗中的大多数都是基于脂质纳米颗粒的,并且处于 1 期和 2 期临床试验阶段。此外,正在进行的临床研究中约有 60-70% 是使用基于 mRNA 的 COVID-19 疫苗平台进行的。因此,我们在下表 1 中总结了所有正在进行的基于 mRNA 的疫苗(不包括 COVID-19 疫苗)的临床试验。如前所述,大多数 mRNA 疫苗处于临床试验的早期阶段(1 或 2 期),只有少数基于 mRNA 的疫苗处于 3 期开发中。以下部分将提供有关目前处于 3 期临床的疫苗的详细信息。
表 1. 正在进行的 mRNA 疫苗临床试验(不包括 COVID-19 疫苗)。

mRNA-1345
mRNA-1345 是 Moderna 开发的、针对呼吸道合胞病毒 (RSV) 感染的候选疫苗,它编码一种称为融合前 F 糖蛋白的 RSV 蛋白,从而引发有效的中和抗体反应。这种蛋白质负责病毒的进入和细胞间的传播,对 RSV 感染的传播至关重要。该疫苗是一种基于脂质纳米颗粒的疫苗,由优化的蛋白质和密码子序列组成。美国 FDA 最近授予 mRNA-1345 快速审查资格,适用于 60 岁以上的成年人。由于免疫反应低下,在 mRNA-1345 之前为 RSV 感染开发的几种疫苗在临床试验中失败了。最近,Moderna 报告了正在进行的 1 期研究的中期结果,该研究评估了 mRNA-1345 在儿童、年轻人、老年人和育龄妇女中的耐受性、反应原性和免疫原性。结果显示,截至数据截止日期,该疫苗在试验的所有剂量水平下均具有良好的耐受性。该研究预计将于 2023 年完成。正在进行 mRNA-1345 疫苗 (NCT05127434) 在 ≥ 60 岁成人中的 2/3 期研究,以评估 mRNA-1345 疫苗的安全性和耐受性,并证明从注射后 14 天到 12 个月,与安慰剂相比,单剂 mRNA-1345 疫苗在预防 RSV 相关下呼吸道疾病 (RSV-LRTD) 首发方面的功效。该研究计划分两个安慰剂对照阶段进行,即 400 至 2000 名参与者的 2 期研究和超过 30,000 名参与者的 3 期研究。该研究的主要目的是评估疫苗的安全性和有效性。安全终点包括监测参与者的不良反应、不良事件、严重不良事件以及特别关注不良事件的发生率。主要疗效终点包括注射后 14 天至注射后 12 个月内 mRNA-1345 预防 RSV-LRTD 首次发作的疫苗效力(VE)。这项研究于 2021 年 11 月开始,预计将于 2024 年 11 月完成 (NCT05127434)。
mRNA-1010
mRNA-1010是Moderna开发的流感四价候选疫苗,根据世界卫生组织的推荐,编码四种季节性流感病毒的表面蛋白、血凝素(HA)蛋白,包括季节性流感A/H1N1、A/ H3N2、流感 B/Yamagata 和 B/Victoria 谱系。HA 被认为是疫苗开发的重要目标,因为它可以产生针对流感的广泛保护,并且是目前可用的流感疫苗的主要目标。mRNA-1010 的功效已在 1 期和 2 期研究中得到评估。2021 年 12 月,Moderna 发布了正在进行的I期研究的中期结果,该研究在年轻人和老年人中评估了 3 种剂量(50 µg、100 µg 和 200 µg)的 mRNA-1010。结果显示,mRNA-1010 在所有参与者接种所有剂量疫苗后 29 天,成功地提高了针对所有毒株的血凝抑制测定的几何平均滴度,没有明显的安全性问题发现。公司还证实,正在进行的 mRNA-1010 2 期研究已达到全部入组人数。正在进行 3 期主动对照研究(NCT05415462),以评估 ≥ 18 岁成年人接种mRNA-1010季节性流感疫苗后的体液免疫反应。活性比较剂是任何获得许可的四价灭活季节性流感疫苗。本研究的主要目标是在第 29 天评估 mRNA-1010 相对于活性对照物对疫苗匹配的 A 型和 B 型流感病毒株的体液免疫原性,并评估 mRNA-1010 的安全性和反应原性。安全终点包括监测参与者的不良反应、不良事件、严重不良事件和特别关注不良事件的发生率。主要疗效终点包括第 29 天抗血凝素 (HA) 抗体的几何平均滴度 (GMT) 以及达到血清转化的参与者百分比。这项研究于 2022 年 6 月开始,预计将于 2023 年 8 月完成 (NCT05415462)。
mRNA-1647
mRNA-1647 是 Moderna 开发的用于育龄妇女巨细胞病毒 (CMV) 感染的候选疫苗。它由六个 mRNA 组成,这些 mRNA 编码 CMV 表面的两种抗原。五个 mRNA 编码形成膜结合五聚体复合物的亚基,而第六个编码全长膜结合糖蛋白 B (gB)。mRNA-1647 疫苗指导人体细胞制造抗原,从而产生功能性抗原,模拟在自然感染期间由 CMV 呈递给免疫系统的抗原。迄今为止,mRNA-1647 疫苗已在1期和2期研究中进行了评估。这两项研究的中期分析结果是积极的,并推动了3期研究的开始,以确认 mRNA-1647 的有效性和安全性。这项 3 期研究 (NCT05085366) 是一项随机、双盲、安慰剂对照研究,旨在评估 mRNA-1647 疫苗在 16 至 40 岁的健康参与者中的功效、安全性和免疫原性。该研究的主要目的是评估 mRNA 1647 疫苗在 CMV 血清阴性女性参与者中的功效,并评估 mRNA-1647 疫苗在所有参与者中的安全性和反应原性。安全终点包括监测参与者的不良反应、不良事件、严重不良事件和特别关注不良事件的发生率。主要疗效终点包括针对未由 mRNA-1647 编码的抗原的血清免疫球蛋白 g (IgG) 从阴性结果到阳性的血清转化(时间范围:第 197 天(第三次注射后 28 天)至第 887 天(第三次注射后 24 个月)第三次注射))。该研究于 2021 年 10 月开始,预计将于 2025 年 7 月完成 (NCT05085366)。
mRNA疫苗的临床安全性
任何候选疫苗临床开发计划中早期临床试验的主要目的是评估其在人群中的安全性。疫苗的安全性在整个临床开发过程中通过主要监测不良事件、死亡、实验室检查结果等进行评估。任何疫苗的上市许可/批准只有在安全性可接受的情况下才有可能。如果在研究过程中发生任何不良事件,监管机构/机构伦理委员会可以停止临床试验,并且可以停止临床开发计划。预计与候选疫苗相关的不良事件应迅速得到解决/恢复。即使在疫苗获得上市许可后,开发方仍有责任监控其安全性。由于核苷的存在,毒性是基于 mRNA 的疫苗需要考虑的重要因素之一。据文献报道,一些核苷类抗癌药和抗病毒药的毒性是由于非天然核苷所致。具体到 mRNA 疫苗,肝毒性是在针对 Crigler-Najjar 综合征开发疫苗的临床前研究期间观察到的最常见毒性。这可能是由于在用于递送的脂质纳米颗粒的配制过程中存在有毒赋形剂。在另一项针对狂犬病的 mRNA 疫苗的研究中,由于 mRNA 的炎症性质,在临床试验中报告了全身性不良事件。与 mRNA 疫苗相关的大部分毒性主要是由于用于制剂的赋形剂或制剂开发过程中使用的其它溶剂。通过在其安全范围内使用赋形剂并遵循减少疫苗中残留有毒成分的流程,可以避免这些毒性。未来,基于 mRNA 的疫苗的预期毒性包括局部和全身炎症、表达的免疫原的生物分布和持久性、自身反应性抗体的刺激,以及任何非天然核苷酸和递送系统成分的潜在毒性作用。除上述之外,这些疫苗还可以诱导有效的 I 型干扰素反应、水肿(由于细胞外裸 RNA)、血液凝固和病理性血栓形成。另一方面,全球卫生当局已经批准了几种 mRNA 疫苗供人类使用。所有批准的疫苗在临床试验评估期间都显示出可接受的安全性。例如,来自 Pfizer–BioNTech (Comirnaty) 和 Moderna (Spikevax) 的两种 COVID-19 mRNA 疫苗已证明具有出色的安全性和有效性。总的来说,临床开发中几种基于 mRNA 的疫苗的安全性是可以接受的(耐受性良好),迄今为止很少甚至没有从临床试验中退出。临床研究期间报告的大多数不良事件包括注射部位反应。通过在非临床开发期间进行彻底的毒性测试,所有开发方都应将安全性视为疫苗开发过程中的一个重要因素。临床试验期间应考虑非临床研究的观察结果,并应仔细监测。






