背景:切向流动过滤 (Tangential flow filtration, TFF) 系统是一种广泛应用于灌流培养的细胞截留装置,但操作时间长带来了巨大的挑战。众所周知的常见问题包括膜污染,这导致滤液流量减少以及产物滞留增加。此前实验对中空纤维中污染行为的影响进行了研究,并发现交替式液流特性、细胞裂解、剪切应力和膜孔径的组合应用是造成这一现象的主要因素。
结果:在这项工作中,使用基于磁悬浮泵的低剪切TFF系统、在小规模灌流生物反应器(200 ml)中对不同的工艺设置和条件进行了测试。利用产生重组单克隆抗体的CHO细胞系验证了一种新的概念,即利用两个磁悬浮泵实现中空纤维的反向流动。采用动态再循环流量时,产品筛分效率可提高30%。此外,通过在短周期内逆转两个交替泵的流量,实现了最小的产物截留率。此外,还发现了高分子量物质透过膜进入灌流工艺收获液流与流动方向和产物筛分程度之间的相关性。
结论:具有反向流动的TFF是交替式切向流 (ATF) 系统的有价值的替代方案,以克服抗体截留,可以在各种规模和恒定的生物反应器体积下使用。与ATF和TFF相比,产物收率和纯度有差异,因此这是工艺设计的一个重要点。
连续强化生物工艺提供了在稳态条件下长期运行的可能性,与传统的补料分批工艺相比,具有更高的操作灵活性、更高的生产率以及更低的占地面积要求。直接集成高细胞密度灌流工艺和连续的下游捕获步骤可以节省巨大的成本。然而,可靠的细胞截留装置是灌流工艺的核心,必须在很长一段时间内发挥作用,而不存在大量的产物截留或滤液中的颗粒突破,以允许持续收集目标产物。
切向流过滤 (TFF) 技术使用循环装置,通常是蠕动泵,将细胞培养物平行于膜表面运输,产生液体剪切,以防止凝胶层在过滤器表面形成。然而,据报道,蠕动泵会由于细胞上的高剪切应力而增加细胞裂解,在这方面,磁悬浮泵为生物工艺处理中的低剪切、无脉冲和连续控制流量应用提供了一种替代方案。泵叶轮悬浮在密封的外壳中,无接触,由电机的磁场驱动,产生连续、均匀的流动,对细胞的剪切极低。交替式切向流(ATF) 系统是近年来越来越流行的单向TFF的替代方案,其使用隔膜泵在中空纤维中来回移动细胞培养物。我们已经讨论过,这种反冲和中空纤维的再生可以获得更好的产物回收率。
灌流滴度决定这一工艺的经济和生态影响。中空纤维过滤系统是生物生产行业高密度灌流细胞培养中细胞截留的首选技术。然而,他们也存在一些问题,如易发生膜污染,从而降低了滤液的收率。TFF或ATF中的产品筛分问题直接影响产品的总收率。有时,中空纤维过滤器中的跨膜压力 (TMP) 会受到影响,导致滤液流量减少,从而导致工艺提前终止。对于中空纤维是超滤的组件,这是很常见的情况。此外,从中空纤维过滤器筛出的产物量的变化会产生不稳定的产品浓度,导致捕获步骤与灌流工艺集成的复杂性增加。
大量的研究旨在确定膜污染的潜在原因,以制定克服产物截留的策略。在下游TFF工艺中,较高的剪切速率可以有利地延缓膜污染;相反,在细胞培养中,过大的剪切应力(通过蠕动泵)通常会导致细胞活性降低,从而对产物的筛选产生负面影响。一些策略使用了大孔过滤器 (孔径高达10 um,而不是用于微过滤的0.2 ~ 0.45 um) 和宽表面孔微滤膜,这样可以防止亚微米颗粒通过更大的膜孔而避免造成不可逆的污染。在这些大孔过滤器的下游,需要一个额外的深层过滤步骤,以从滤液流中去除小颗粒。其它研究已经证明,ATF是在重组蛋白生产中提高筛分效率的优选方法,同时实现高细胞密度。研究还表明,在基于ATF的灌流培养中,具有定义的交替流范围的优化工艺操作可进一步减少产物截留和柱堵塞。此外,对ATF和TFF灌流培养中膜污染机理模型的研究揭示了导致产物截留问题的滤饼形成理论,以及其它因素,如过滤器材质、孔径、消泡剂、剪切应力和产物的聚集倾向。过滤器材质和表面电荷的影响尚未得到广泛研究。聚砜 (PS) 和聚醚砜 (PES) 材质由于亲水性而具有较低的蛋白结合性能。然而,PS可以促进蛋白质和裂解细胞之间的相互作用,因为它有更高的负电荷密度。因此,后者比由PES制成的中空纤维具有更高的产物截留。
除了严重的膜污染和由此产生的低产品筛分,细胞培养过程中蛋白质聚集的存在也会大大降低产物收率。在溶液中,单克隆抗体经常聚集到高分子量物种 (HMW),这是一种由二聚体、三聚体或较大的寡聚体组成的聚集物子集。蛋白质聚集取决于多种因素,包括蛋白质组成、蛋白质表达、工艺条件或稳定性。HMWS的形成可能引起潜在的安全问题,如免疫原性,也可能对生产过程产生重大影响。高比例的高分子量物质通常是不可取的,因为它增加了纯化中消除高分子量物质所需的工作 (例如增加纯化步骤的数量),从而导致下游工艺产量降低。因此,监测和了解细胞培养过程中蛋白质的聚集,特别是在集成的连续工艺中,是非常必要的。
在本研究中,与蠕动泵相比,磁悬浮泵以更低的剪切来确保细胞悬浮液的循环,在TFF灌流培养中进行了评估,目的是评估其在产物截留和对细胞培养性能的影响方面的性能,如细胞活性、生长速率、细胞特异性生产力。然后对经典的TFF模式进行了修改,得到了一个动态的再循环流动模式,随着TMP在中空纤维过滤器上的“脉动”,假设这可以减少可逆的膜污染,并对此进行了量化。另一种克服产品筛分衰变的尝试是通过应用反向流 (rTFF),在TFF的回流线上安装第二个磁悬浮泵进行研究。并与传统交替式切向流过滤系统的筛分性能进行了比较。在这些不同的操作模式下,对单克隆抗体单体和HMWS的分析进行了研究。
详细的实验操作和结果以及分析,请参考原文。
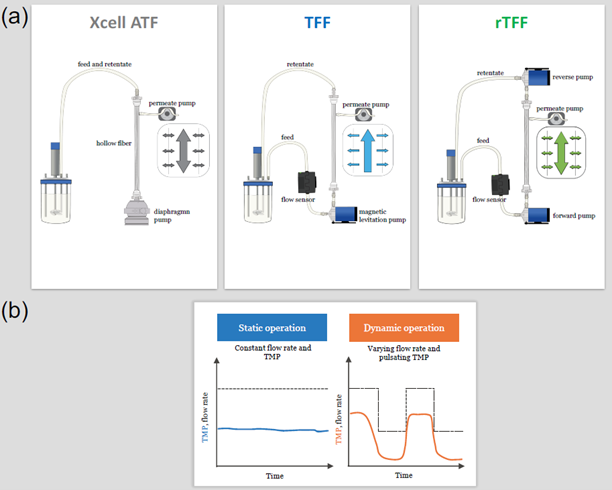
图1. (a)本研究中使用的灌流工艺设置。交替式切向流过滤 (ATF) 模式,使用市售XCell ATF2装置,显示隔膜泵外壳。切向流过滤 (TFF) 模式,通过中空纤维进行单向流动,通过外夹卡箍式流量传感器在反馈回路中控制低剪切一次性泵。反向切向流过滤 (rTFF) 模式,应用两个磁悬浮泵,通过一个外夹卡箍式流量传感器的反馈信号控制跨膜交替流动。箭头表示流动方向 (TFF模式下为单向,ATF和rTFF模式下为双向)。中空纤维滤液出口的泵用于控制收获流量 (H)。(b) TFF静态和动态运行。在静态操作 (运行#TFF1) 中,恒定的再循环流量会产生恒定的TMP (如果没有或污染很小)。在动态操作 (运行#TFF2) 中,流量由阶跃函数控制,从而产生脉动TMP特性。
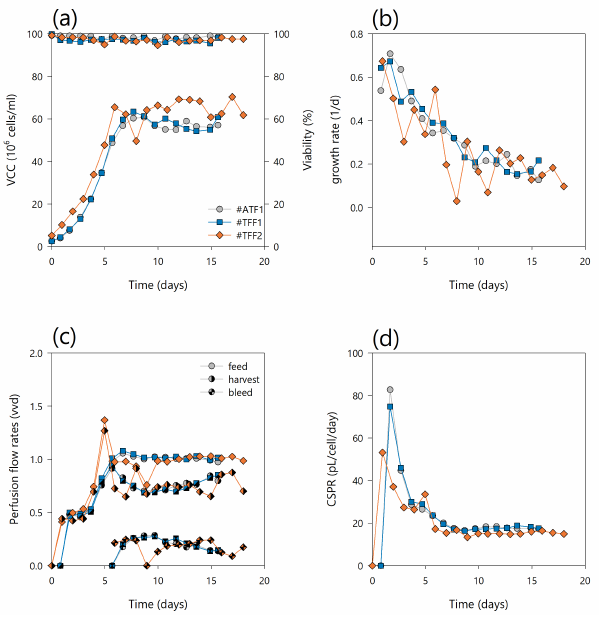
图2. (a)活细胞浓度(左y轴)和活细胞活性 (右y轴);(b) 细胞特异性生长速率-u;(c) 灌流速率 (实心符号)、收获率 (半实心符号) 以及废弃率 (沙漏符号) 以及(d) 细胞特异性灌流率-灌流培养中的cspr #ATF1 (灰色圆圈)、#TFF1(蓝色方块)和#TFF2(橙色菱形)。
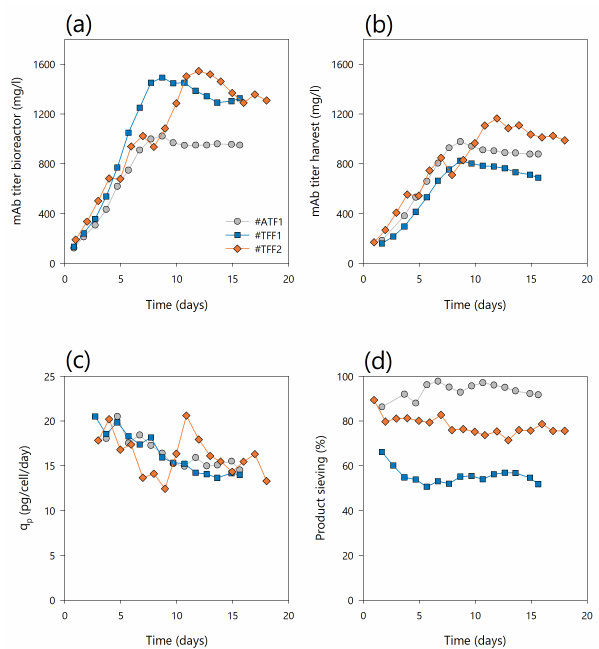
图3. (a) 生物反应器中单克隆抗体(mAb)滴度;(b) 灌流收获中的mAb滴度;(c) 细胞特异性生产力- qp和 (d) 灌流培养中产品筛分#ATF1(灰色圆圈),#TFF1(蓝色方块)和#TFF2(橙色菱形)。通过收获液中IgG浓度与生物反应器中IgG浓度的比值来评估产物筛分。100%的比例表示没有产品滞留。
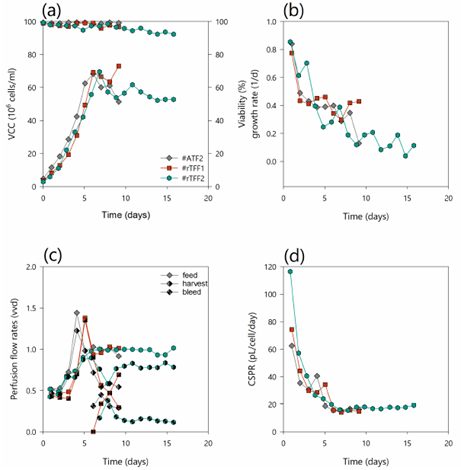
图4. (a)活细胞浓度(左y轴)和活细胞活性(右y轴);(b)细胞特异性生长速率-u (cl灌流率(实心符号),收获率 (半实心符号)以及废弃率(沙漏符号)和(d)细胞特异性灌流率-灌流培养中的cspr #ATF2(深灰色菱形),#rTFF1(红色方框)和#rTFF2(蓝绿色六边形)。
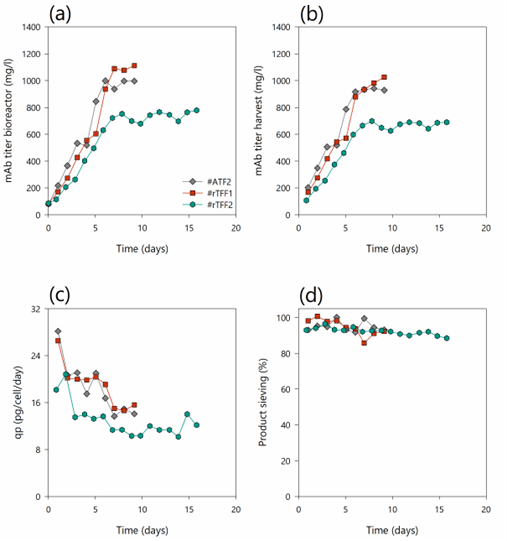
图5. (a) 生物反应器中的单抗滴度;(b)灌流收获中的单抗滴度;(c)细胞特异性生产力-qp和(d)灌流培养中产物筛分 #ATF2 (深灰色菱形),#rTFF1(红色方框)和#rTFF2(蓝绿色六边形)。
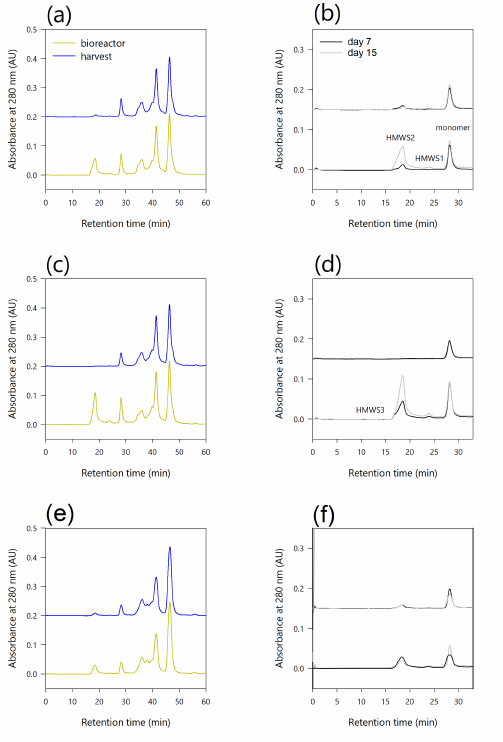
图6. 培养第15天,单抗细胞培养生物反应器样品 (绿色) 和灌流收获 (蓝色) 的SEC分析。CHO细胞培养上清用普通SEC (TSKgel G300owXL)色谱柱分析。灌流培养的SEC色谱图(a) #ATF1, (c) #TFF1和(e) #rTFF2。在生物反应器中,单体和高分子量物种 (HMWS) 在第7天 (黑色) 和第15天 (灰色线) 的峰值,来自灌流运行(b) #ATF1, (d) #TFF1和(f) #rTFF2的收获样品。
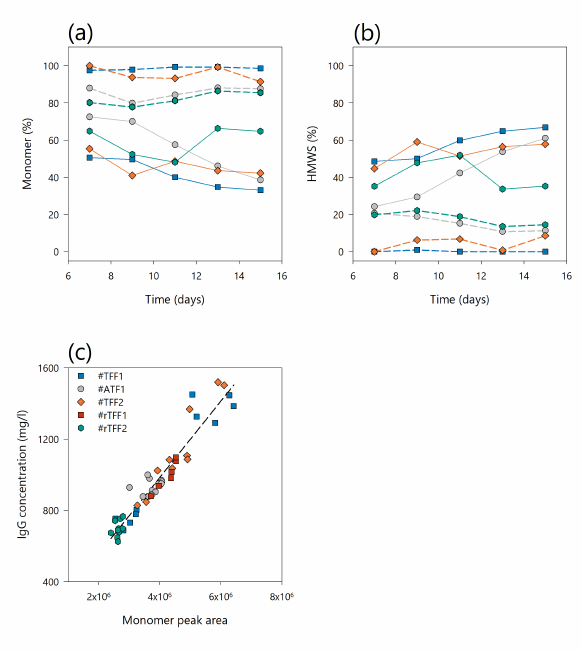
图7. (a)单体峰的相对数量和(b)高分子量物种(HMWS)与生物反应器总峰面积(实线)和灌流收获(虚线)在灌流培养#ATF1(灰色圆圈),#TFF1(蓝色方块),#TFF2(橙色菱形)和#rTFF2(蓝绿色六边形)随时间的关系。(c) 5种不同灌流培养物中IgG浓度(Cedex BioHT测定)与单体峰响应(280 nm)之间的线性相关。
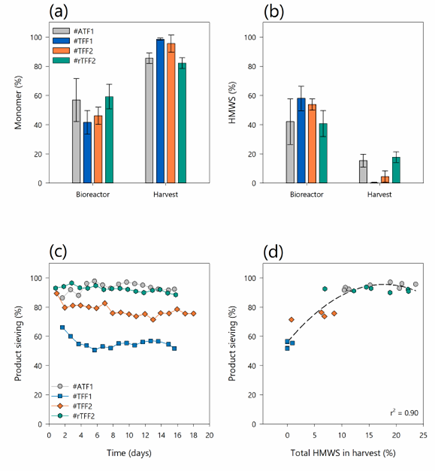
图8. (a)生物反应器稳态阶段和灌流收获期间的平均(n5)单体分数和(b) HMWS分数与总峰面积的关系。误差条表示标准偏差。(c)产物筛分曲线与时间的关系;(d)产物筛分系数与灌流培养中收获的HMWS总含量的关系#ATF1(灰色圆圈)、#TFF1(蓝色方块)、#TFF2(橙色菱形)和#rTFF2(蓝绿色六边形)。采用二次回归法对两组参数之间的关系进行建模。
总结
利用磁悬浮泵,证明了低剪切TFF操作在小型灌流生物反应器中连续生产抗体的适用性。我们利用磁悬浮泵对基于TFF的灌流培养中的产品筛分现象提供了两种解决方案。通过在中空纤维上施加动态再循环流,脉动TMP比恒定的单向TFF流促进了25%的产物通过。更值得注意的是,通过使用两个磁悬浮泵(rTFF)在中空纤维上应用反向流动的新概念,显示了TFF灌流细胞培养中产物截留现象的全面改善。在纤维的回流一侧安装第二个泵,从而使用正向和反向流,在整个过程中实现了接近100%的产物透过。在恒定剪切速率和循环剪切速率下,对不同的工艺设置进行了性能测试。结果,细胞不受剪切应力的影响,并在所有系统中表现出相似的生长和生产行为,分别与剪切速率和操作模式 (ATF、(r)TFF)无关。与传统ATF系统相比,这一应用于TFF逆流的综合解决方案产生了一个稳健、易于建立和类似的灌流工艺,具有在恒定生物反应器滞留体积下运行的优势。
此外,数据表明,中空纤维灌流工艺过程中的膜污染不仅会影响产物的收率,还会影响产物的纯度。综上所述,单向TFF模式比动态和反向TFF模式具有更大的截留率,从而导致更差的产物收率。因此,TFF工艺由于较低的HMW含量 (较高的抗体纯度) 而产生较纯的收获流,但由于抗体截留在生物反应器中而产生较低的产物收率。结果表明,在单向和双向流动中,灌流收获的HMW杂质量不同。与在TFF模式下相比,在ATF和rTFF模式下,收获流中较高水平的蛋白质杂质对产物总收率的影响更大。因此,在交替式切向流过滤系统中获得的较高产物收率并不同时导致较高的产物纯度。因此,要处理的物料的纯度会根据灌流工艺设置的不同而不同,因此对下游单元来说是一个挑战。可以在产品筛分系数和HMWS水平之间建立相关性,以推断来自不同设置的杂质的程度。这为集成式连续生物工艺的操作提供了重要机会,其中可基于筛分系数使用此相关性来相应地调整下游纯化步骤。因此,可以实现一致的产物纯度或聚体/HMW杂质的分离。在考虑一个完全集成的连续工艺时,不同HMWS水平和物质对纯化工艺的影响仍然需要在未来的研究中加以考虑。






