小型设备可实现快速开发和优化,虽然有许多设备用于补料分批培养,但几乎没有可用于高细胞密度灌流培养的设备。为了弥补这一差距,在 mL 级微孔板中开发了伪灌流方法,能够实现灌流培养的许多特定特征,包括高细胞密度、细胞截留以及提高生产力。在每天 1-2 次培养基置换之前,通过沉淀或离心 24 孔微孔板实现假灌流,产生高于 90% 的分离效率。培养基置换在第 3 天开始,达到每天 0.5-1.8 个罐体积 (VVD) 的灌流率。伪灌流方法实现最大活细胞密度 (VCD) 高达 42 × 10^6 cells/mL,比补料分批培养高 4.2 倍。体积生产率增加了 1.9 倍,产生了与工业水平相关的生产率。在沉降法和离心法之间观察到类似的性能,当使用沉降法时,由于操作时间延长和分离前细胞密度降低而导致的微小偏差。微孔板 (MWP) 实验在 5 L 规模下进行了验证,并显示出代谢物和生长曲线的可比性。这项工作展示了一种用于高通量开发研究的强大工具,该工具对培养基成分和置换率的变化很敏感,可以可靠地用于高细胞密度灌流培养的初步筛选。
简介
随着单克隆抗体 (mAb) 等治疗性蛋白质的生产规模越来越大,行业正在转向连续工艺,以提高效率。灌流培养方法的实施提供了更高的生产率、更小的设施占地面积和更低的商品成本,但该技术的广泛采用受到批次失败的高风险和设置的复杂性的阻碍。与补料分批相比,最近的技术进步降低了失败率,提高了灌流培养的生产率并减少了批次间的可变性。此外,长期稳态灌流培养操作可确保产品质量始终如一,这促使监管机构提出了推动实施连续生物生产的举措。
有人提出,灌流培养方法的成功取决于降低灌流速率的能力,理想情况下降至每天 1 个罐体积 (VVD) 以下。这确保了使用最少的液体吞吐量实现高滴度,从而降低了运营成本。为了降低灌流速率,必须仔细选择细胞系,并优化培养基,以确保适当的营养深度和渗透压。使用高通量 mL 规模设备提供了选择性能最佳的细胞系并通过并行运行实验进行培养基研究的可能性,从而减少了与早期开发相关的时间尺度和成本。虽然微孔板和微型生物反应器等设备已广泛用于补料分批培养,但灌流培养的等效平台仍在开发中。由于灌流操作需要优化多个过程参数,因此在 L 级规模台式生物反应器中执行时,这可能是资源密集型和低通量的。作为替代方案,通常使用摇瓶、摇管或微孔板中的伪灌流。
这些伪灌流系统的几个例子之前已经被描述过,将“离散”的培养基置换和细胞截留整合到用于 CHO 细胞培养的预先存在的补料分批工艺中。示例包括摇瓶、离心管和mL级生物反应器。伪灌流摇瓶已达到 70 × 10^6 cells/mL 的细胞密度。然而,摇瓶是劳动密集型的,并且它们的操作难以自动化,而自动化在筛选 100 种条件时是非常可取的策略。摇管的工作体积通常在 10 到 50 mL 之间,并以 220 到 320 rpm 之间的速度 N 摇动。细胞分离是通过在培养基交换之前离心来实现的,在工作体积的 40% 和 100% 之间变化。Villiger-Oberbek 等人报告活细胞密度高达 50 × 10^6 cells/mL,而 Karst 等人维持 15 × 10^6 cells/mL 的稳定相培养以进行动态代谢分析。已报道使用 ambr15® 模拟灌流培养,利用沉淀作为细胞截留机制或采用恒化器模式。沉降方法需要 40-60 分钟的时间,以允许细胞沉降,其中包括在去除上清液和每天最多 8 次在培养基添加之前临时关闭 pH、DO 和搅拌器控制。然而,在沉淀过程中长时间关闭控制可能会导致 pH 值和 DO 峰值,随着培养的进行,对细胞健康有害。恒化器模式包括脉冲培养基添加,无需任何细胞截留步骤,同时保持恒定体积。据报道,活细胞密度高达 20 × 10^5 cells/mL,虽然周期性培养基置换可以被认为是模拟灌流方法中大量培养基置换的基础,但这种方法受限于没有细胞截留步骤。此外,ambr250® 可用于模拟灌流培养,但这可能涉及大量购买和运营成本。到目前为止提出的所有方法的工作体积都在 10 到 250 mL 之间,但是,为了进行初步筛选和优化研究,工作体积更低的平台将允许以更低的成本进行高通量实验。
微孔板经常用于批次和补料分批细胞培养的高通量开发研究。与摇瓶、摇管和微型生物反应器相比,其有可能显著降低运营成本,并大大提高实验通量。使用板盖可最大限度地减少蒸发,同时最大限度地提高氧转移率,这意味着微孔培养能够在无菌环境中长时间维持。微孔板依赖于顶空氧气转移,振荡速度和表面积与体积比被确定为最大化氧气转移的重要影响因素,即影响气液传质系数 kLa。虽然 kLa 随着振荡频率的增加而增加,但可能会达到临界振荡速度,在该速度下可能会观察到对细胞培养的不利影响。据报道,5-55 hr-1 的 kLa 支持高达 10^8 cells/mL,据报道,24 孔板的 kLa 为 12 hr-1,填充体积为 1 mL,以 225 rpm 的速度摇动并覆盖具有透气膜。因此,已公布的微孔板 kLa 值表明氧气不会成为细胞密度高于 10^7 时 CHO 细胞生长的限制因素。
Huang等在工作体积为 3 mL 的 24 孔板中开发了一种方法,其中细胞以目标细胞密度接种,介于 20 和 30 × 10^6 cells/mL 之间。在他们的工作中,使用 100% 的工作体积通过每日离心和培养基置换来维持恒定的细胞密度。稳定培养的研究表明是代谢分析的有用工具,但是稳定相的分析仅限制了选择性能最佳的细胞克隆和培养基的能力。在这项工作中,描述了微孔板中伪灌流方法的开发,该方法能够实现生物反应器灌流培养的特征,即细胞截留能力、高细胞密度和提高的生产力。两种关键的细胞截留方法,沉淀和离心,已经以微孔板形式开发并与培养步骤相结合,以允许对每种方法作为竞争性选项进行比较和严格评估。
详细的试验方法、结果与讨论,请参考原文。
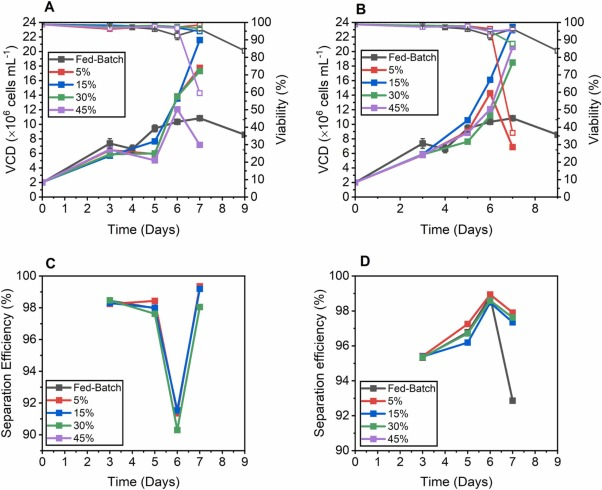
图 1. 补料分批、沉降和离心培养的性能比较,使用添加有 5%、15%、30% 和 45% EfficientFeed™ B v/v 的培养基进行置换。在 1 VVD 条件下,补料分批培养和沉淀培养 的(A) VCD(实心方块)和活性趋势(空心方块)。(B) 补料分批培养和离心培养的 VCD(实心方块)和活性(空心方块)。(C) 沉淀培养的分离效率。(D) 离心培养物的分离效率。
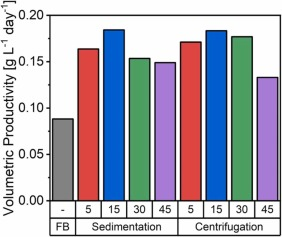
图 2. 补料分批培养和沉降以及离心伪灌流培养的单位体积生产率比较,使用添加有 5%、15%、30% 或 45% EfficientFeed™ B 的培养基进行置换。
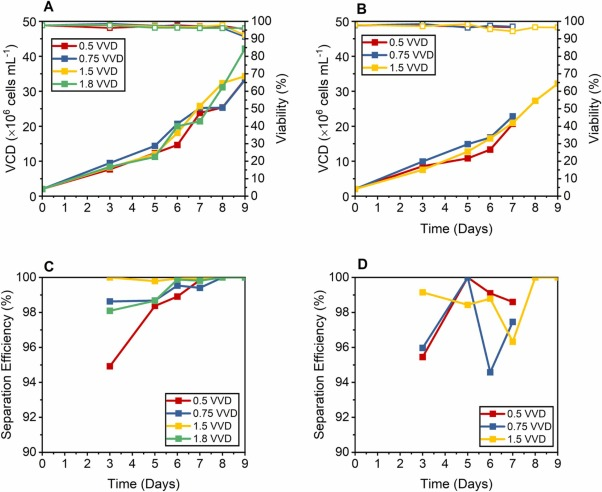
图 3. 沉降和离心培养物的性能比较,使用添加有 15% EfficientFeed™ B v/v 的培养基,分别以 0.5、0.75、1.5 和 1.8 VVD 进行置换,(A) 沉淀培养的VCD(实心方块)和活性趋势, (B) 离心培养的 VCD(实心方块)和活性趋势(空心方块)。(C) 沉淀培养的分离效率。(D) 离心培养的分离效率。1.8 VVD 未进行沉降测试,因为每天两次的最大交换体积为 75%。
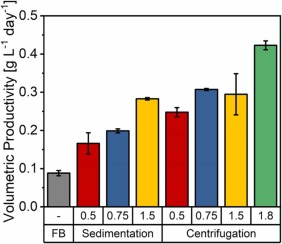
图 4. 沉淀和离心伪灌流培养的单位体积生产率比较,使用添加了 15% EfficientFeed™ B 的培养基进行置换,置换率为 0.5、0.75、1.5 和 1.8 VVD。这些值代表培养期间单位体积生产率的平均值。由于每天两次的最大置换体积为 75%,因此未对 1.8 VVD 的灌流速率进行沉降测试。
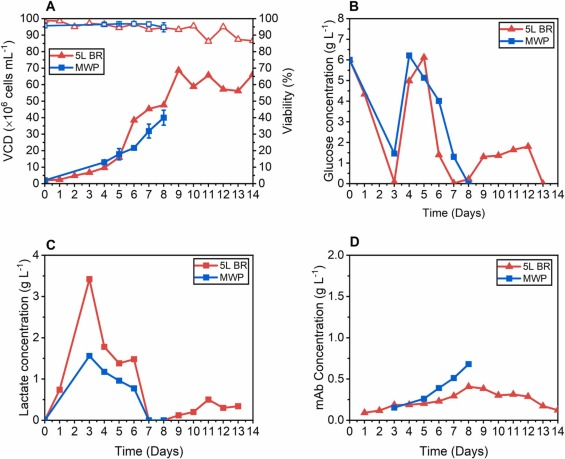
图 5. MWP 伪灌流方法与 5 L 灌流生物反应器的比较 (A) VCD 生长曲线(实心方块)和相关细胞活性(空心方块)(B) 葡萄糖浓度 (C) 乳酸浓度和 (D) mAb浓度。
总结
与补料分批培养相比,在微孔板中开发了一种伪灌流方法,该方法结合了细胞截留能力并产生更高的细胞密度和单位体积生产率。沉淀和离心方法具有相似的培养性能,但由于在沉淀培养中分离之前更长的操作时间和较低的累积细胞密度而存在微小偏差。伪灌流方法被证明对培养基成分的变化很敏感,这使得该系统有望用于灌流培养的早期开发。在分析的所有条件下,使用伪灌流方法延长至第 9 天的培养中达到的最高 VCD 比补料分批操作高 3.3-4.2 倍。1.5 和 1.8 VVD 的更高灌流速率以及更高的 CSPR,在 0.05 和 0.06 nL/cell/day 之间,产生的单位体积生产率比补料分批高 1.9 倍,并且提高微孔板中的伪灌流方法能够模仿灌流培养的许多具体特征,与之前报道的伪灌流技术相比,体积减少了 8 倍。一组选定的工艺参数(即 1VVD)被转移到 5L 灌流生物反应器中,显示出可比较的细胞生长和生产力结果。微孔板中的伪灌流方法是用于灌流培养早期开发和筛选的强大、高通量工具。将该系统集成到自动液体处理设备中可以进一步扩展功能,提高可靠性和一致性。
原文:M. Tregidgo, C. Lucas, M. Dorn, et al., Development of mL-scale pseudo-perfusion methodologies for high-throughput early phase development studies. Biochemical Engineering Journal, 2023.






