在过去的四十年里,使用病毒载体进行基因治疗的临床试验数量显著增加。这段时间,有很多重大发现,也有很多挫折。尽管存在这些早期障碍,但该领域的深入研究仍在继续,这些努力已推动许多基于病毒载体的疗法获得批准,许多其它疗法目前正在进行后期临床试验。这些疗法主要专注于治疗不同的癌症,少数专注于治疗单基因、心血管和传染病。在过去的 20 年中,已经批准了 20 多种基于病毒载体的疗法,其中 7 种是基于腺病毒、腺相关和慢病毒载体的疗法(原文发表时间为2022年1月)。
获批的病毒载体疗法
在 1990 年代初期,一种腺病毒载体被批准用于临床试验,是首批获得批准的病毒载体之一。从那时起,一些腺病毒载体已被批准广泛使用。“Gendicine”是第一个获得批准的病毒载体技术,于 2003 年被中国食品药品监督管理局 (CFDA) 批准用于治疗头颈部鳞状细胞癌患者。Gendicine 是一种重组腺病毒,可表达肿瘤抑制蛋白 p53。截至 2020 年,已有30,000 名患者接受了 Gendicine 的治疗,当与化疗、放疗和其它常规治疗结合使用时,观察到的患者反应率显著提高。将这种病毒系统与传统治疗相结合的临床结果比单独使用传统治疗更有效。许多癌性肿瘤是 p53 基因突变的结果,因此许多临床研究目前正在进行中,Gendicine 用于治疗其它类型的癌症,包括乳腺癌、肝癌、胰腺癌和结直肠癌,正变得越来越普遍。另一种基于腺病毒载体的疗法,称为 Oncorine,于 2005 年获得CFDA的批准。Oncorine 用于治疗晚期难治性鼻咽癌,并且在与化学疗法和放射疗法结合使用时非常成功。由于 E2B 55K 区域的缺失,该载体只能在 p53 缺陷细胞中感染和复制,导致这些细胞的溶瘤效果。
AAV 载体此前没有像腺病毒载体那样被深入研究,然而,它们自 1960 年代被发现以来已经获得极大成功。已经批准了三种基于 AAV 载体的治疗方法,其中两种仍在市场上。Glybera 是一种基于 AAV 载体的疗法,于 2012 年获得欧洲医疗机构的批准。Glybera 向脂蛋白脂肪酶缺乏的患者提供脂蛋白脂肪酶。尽管这种疗法能够有效地治疗该疾病,但在市场上提供该疗法在经济上是不可行的,因为这种疾病的发病率是百万分之一,因此在 2017 年停止使用。Luxturna 是另一种 AAV 载体疗法,于 2017 年在美国获得 FDA 批准。它适用于患有称为 Lebers 先天性黑蒙的遗传性视网膜疾病的患者,这种疾病会导致进行性失明。Luxturna 也是一种非常昂贵的治疗方法(每只眼睛 425,000 美元)。然而,由于更多的人受到 Lebers 先天性黑蒙的影响,该产品一直留在市场上。另一种成功的 AAV 载体疗法更加昂贵,即Zolgensma,用于治疗脊髓性肌萎缩症患者。该疗法通过递送运动神经元存活转基因来取代患者体内的非功能基因。它于 2019 年获得 FDA 批准,并且已经看到患者改善到可以无支撑行走的程度,这在这种治疗出现之前是不可能的。
与 AAV 载体类似,慢病毒载体的研究时间不及其它载体系统,但从 2003 年首次用于临床试验开始,它们就非常成功。Kymriah 于 2017 年被FDA 批准用于治疗小儿复发性 B 细胞急性淋巴细胞白血病。Kymriah 是第一个基于慢病毒载体的基因疗法以及第一个嵌合抗原受体 (CAR) T 细胞免疫疗法。这种肿瘤疗法允许对患者自身的 T 细胞进行离体基因工程修饰,使其能够识别和消除 CD19 阳性细胞。这是一种非常成功的治疗方法,淋巴细胞白血病患者在治疗后的很长一段时间内都达到了缓解。Yescarta 是另一种使用 CAR T 细胞免疫疗法治疗成人复发性 B 细胞淋巴瘤的慢病毒载体技术。Yescarta 于 2017 年获得 FDA 批准,在治疗这种疾病方面非常有效。
临床试验中的病毒载体疗法
在过去的四十年中,已经有超过 3000 项批准、正在进行或完成的临床试验涉及使用病毒载体进行基因治疗。随着基因治疗领域的持续研究成功,正在研究的疾病范围已经显著扩大。许多不同类型癌症的基因治疗临床试验目前正在进行中,包括头颈癌、肺癌、卵巢癌、乳腺癌、前列腺癌、肝细胞癌和黑色素瘤。还研究了许多单基因疾病,包括 SCID-X1、ADA-SCID、粘多糖贮积症和Fanconi贫血,以及 HIV 和最近的 COVID-19 等传染病。逆转录病毒、腺病毒、腺相关病毒和慢病毒载体占 3000 项临床试验的一半以上,如前所述,它们已转化为已上市的批准治疗方法。从目前临床试验数据的趋势来看,可以推断出基于病毒载体的基因治疗未来的发展方向(图 2)。
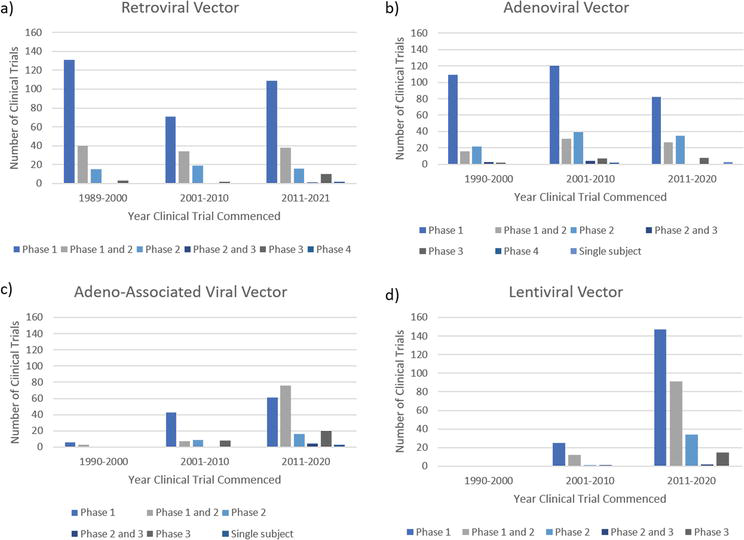
图 2. 1989 年至 2021 年进行的、涉及逆转录病毒、腺病毒、腺相关和慢病毒载体(分别为 a-d)的体内和体外临床试验。
在 1990 年代,逆转录病毒载体是临床试验中最常用的病毒载体,用于治疗多种疾病,包括不同的肿瘤类型、单基因疾病和 HIV(图 2a)。尽管 30 年前是最流行的病毒载体选择,但逆转录病毒载体的使用一直在稳步下降。这种现象很可能是由于它不能用于非分裂细胞以及插入肿瘤发生的风险,导致癌细胞形成。尽管使用逆转录病毒载体完成了 536 项临床试验。一种名为 Strimvelis 的治疗方法已上市,但已被下市。Strimvelis 于 2016 年被欧洲药品管理局批准用于治疗 ADA-SCID,使用逆转录病毒载体通过离体递送将腺苷递送至患者的细胞。然而,Orchard Therapeutics 报道了 2020 年患者发生白血病的事件,该公司已停止治疗,直到风险因素得到更好的了解并可以减轻。目前正在意大利进行一项针对 50 名患者的观察性临床跟踪研究,该研究将进行至少 15 年。为了使逆转录病毒载体在未来获得更大的应用,需要对插入诱变的机制和提高安全性的方法进行更多的研究。
在所有病毒载体中,腺病毒载体最常用于临床试验,有 573 个已获批准、正在进行或已完成的项目(图 2b)。目前市场上有两种用于肿瘤治疗的疗法,另外两种在后期临床试验中,腺病毒载体研究和基因治疗方法取得了相当大的成功。70% 的临床试验用于肿瘤治疗,腺病毒载体已成为全球肿瘤基因治疗中最流行的病毒载体。腺病毒载体因其高免疫原性而成为肿瘤治疗的热门选择。虽然在其它情况下无益,但诱导强烈的促炎反应对肿瘤治疗非常有利。然而,与逆转录病毒载体一样,腺病毒载体的使用在过去十年中有所下降。这可能是因为它们缺乏对晚期临床试验的转化,以及在基因治疗临床试验中使用腺相关病毒和慢病毒载体的增加。
与其它载体系统相比,腺相关病毒载体已用于一定数量的临床试验,并取得了相当程度的临床成功。在过去的十年中,两种基于 AAV 载体的疗法进入市场,且 I 期和 II 期临床试验的数量急剧增加(图 2c)。尽管许多 AAV 载体 I 期试验没有像其它载体试验那样早开始,但截至 2021 年,已拥有最多的 III 期试验获批、正在进行或完成项目(图 2c)。AAV 载体还在一系列疾病中显示出临床疗效,包括抗胰蛋白酶缺乏症、眼部疾病和血友病。看到 AAV 载体仅在过去 20 年取得的进步,它们似乎是针对未来使用的有前途的技术。在审查临床试验数据时,另一项有前途的技术是慢病毒载体。慢病毒载体在过去十年中获得批准、正在进行或完成的临床试验数量最多,尽管在 2010 年之前数量最少(图 2d)。慢病毒载体应用主要关注的一些疾病包括肿瘤、β-地中海贫血、艾滋病毒和范可尼贫血。使用慢病毒载体而不是逆转录病毒载体进行转基因传递的好处是它们可以转导缓慢分裂或非分裂的细胞,并且似乎对整合到致癌位点的亲和力较低,尤其是自我失活的第三代慢病毒载体。这些具有强启动子的慢病毒载体在很大程度上降低了插入诱变的风险,然而,这种风险并没有完全消除。一种自灭活慢病毒载体已用于治疗 HIV 的临床试验,共有 65 名患者接受了该载体治疗,并且在载体输注后 8 年以上未报告任何不良事件。分析过去三十年有限数量的不良事件和成功的临床试验数据表明,AAV 和慢病毒载体都是未来有利的基因治疗技术。
基于病毒载体的基因治疗面临的担忧
尽管它们在基因治疗临床试验中取得了越来越大的成功,但病毒载体技术仍然需要克服许多问题才能被接受为广泛的治疗选择。使用病毒载体的关键挑战是在体内递送时诱导免疫反应、确定所需的最佳治疗剂量、生产成本以及转基因表达水平的精确调节。
免疫反应
病毒载体的免疫原性既可以通过免疫反应随时间的大小进行定量测量,也可以通过触发的免疫反应类型进行定性测量。许多因素决定了载体的免疫原性,并且根据病毒载体系统的结构而有很大差异。在进入临床试验之前了解载体与免疫系统的相互作用至关重要,因为注射后发生严重的免疫反应会导致许多严重的并发症,在某些情况下甚至会导致死亡
腺病毒和腺相关病毒载体尤其受到免疫方面的关注。不同腺病毒血清型的流行因地区而异。例如,血清型 5 (Ad5) 在美国的流行率为 50%,但在非洲,这一比例接近 100% [56]。尽管存在这些差异,但腺病毒通常在环境中普遍存在并且具有高度免疫原性,这在使用相同血清型施用载体时可能会引起关注。如果患者已经暴露于治疗载体中使用的血清型,这可能会导致强烈的免疫反应,其特征是预先存在的中和抗体快速流入注射部位,从而减少治疗剂量并限制载体发挥其临床效果的能力,并由于补体激活和由此引起的炎症引起患者的安全问题。这与 AAV 的情况类似,因为全世界大约 80% 的人口已经接触过某种 AAV 血清型。以前接触血清型被证明是腺病毒和 AAV 载体临床试验中需要克服的主要障碍。然而,在某些情况下,高免疫原性载体可能有益于治疗某些疾病。腺病毒载体是最常见的癌症治疗载体,主要是因为它们具有高度免疫原性。通过溶瘤腺病毒治疗触发抗肿瘤反应已被证明在市场上两种批准的癌症治疗方法中取得了一些成功。
与腺病毒载体相比,慢病毒载体具有非常有利的免疫原性特征,这是它们在过去十年中成为流行载体选择的一个主要原因。人类的慢病毒感染非常有限,因此,只有一小部分人会携带预先存在的病毒抗体。此外,在许多慢病毒载体系统中,水疱性口炎病毒囊膜糖蛋白 (VSV-G) 的原始病毒囊膜已被替换。慢病毒载体触发持久的 T 细胞免疫,不会引起不利的载体特异性免疫或炎症反应,从而有利于临床应用。
生产成本
如果最终目标是临床应用,则生产病毒载体的成本是一个重要的考虑因素。病毒载体系统的生产需要考虑许多成本,包括设备、实验室材料、纯化、储存和所需的劳动力。以基于 AAV 载体的基因疗法 Glybera 为例,如果该产品生产成本太高且受该疾病影响的患者数量太少,该产品留在市场上可能在经济上不可行。载体生产成本的一个主要因素是一名患者所需的剂量。例如,较低的接种剂量可以抵消较大的生产成本。降低生产大量载体的成本和时间的一种方法是使载体具有高滴度水平。腺病毒载体在基因递送方面非常有效,这些载体的滴度非常高,这在大规模生产时是有益的。腺病毒载体是一种非常受欢迎的疫苗接种选择,其高滴度特性是其受欢迎的部分原因。总的来说,生产病毒载体的成本是一个重大障碍,如果它们要在商业规模上使用,就必须克服这个障碍。目前有很多研究致力于简化载体生产过程,以降低生产所需的成本和时间,并允许在资源匮乏的地区进行生产。
转基因的表达
使用病毒载体的另一个考虑因素是转基因的递送以及这个过程可以控制到什么程度。将特定基因递送至细胞的能力已被证明是一种非常有效的治疗方法,但是,如果这不以规范的方式发生,则可能对患者有害,尤其是在随机整合的情况下。转基因表达有时似乎是不可预测的,研究表明在某些情况下遗传变异会影响表达。根据条件,转基因需要在不同的水平上表达,并且可能仅在特定区域或细胞类型中表达。为了控制转基因的表达和对抗不可预测性,已经实施了诸如使用组织特异性启动子和自我失活的策略。组织特异性启动子将转基因的表达限制在某些细胞类型中,从而限制了广泛的表达。当在治疗上用于靶向特定细胞或组织类型并避免在非靶细胞或组织中表达时,这是理想的。此外,如在第三代慢病毒载体中所见,已纳入自我失活机制。3'LTR的修饰阻止了一轮整合后的继续表达,有效地允许转基因表达的量通过载体的剂量来控制。尽管取得了这些积极成果,但仍需要进一步研究,以实现严格调控的转基因表达。
结论
在过去的二十年里,基于病毒载体的基因疗法取得了非常令人鼓舞的进展,这表明这种疗法在医学上有着积极的前景。据 IQVIA 报道,2021 年上半年,风险投资公司对生物制药公司的投资创历史新高,其中细胞和基因疗法吸引了大量投资。2021 年医药并购 (M&A) 的价值与前一年相比显著增长,其中许多是基于病毒载体和基因治疗的交易。虽然这些对于病毒载体使用的未来来说是有希望的统计数据,但这种基因治疗方法所面临的问题仍然存在,并且需要大量的研究来克服这些问题。展望未来,考虑到临床试验数据和每种病毒载体的缺点,慢病毒和腺相关病毒载体似乎是未来重点研究的最有利选择。由于不良反应有限且免疫原性良好,这些病毒载体有可能成为现代医学的关键治疗方法。
本文为以下文献内容简介,详细内容,请参考原文。本文旨在知识、信息分享,转载请注明出处和原文。
原文:A.L.G.Mahoney, N.T.Nassif, B.A.O’Brien, et al., Viral Vectors in Gene Therapy and Clinical Applications. Molecular Cloning, 2022.






