随着最近埃博拉和新冠病毒产品的批准,腺病毒载体已成为一类重要的疫苗。在腺病毒载体制造过程中收集的过程质量属性数据主要集中在颗粒浓度和感染性比例(基于病毒基因组:针对细胞的感染性),数据表明最终疫苗产品中只有一小部分病毒颗粒是有效的。为了更好地了解这种产品的异质性,使用透射电镜 (TEM) 研究了两种腺病毒载体 (黑猩猩腺病毒(ChAdOx1) 和人类腺病毒5型 (Ad5)) 的实验室规模制备。对不同的腺病毒形态进行了表征,并对空颗粒和完整颗粒的比例进行了量化。这些比例与样品的感染性值表现出定性的相关性。采用液相色谱-质谱 (LC-MS) 多肽图谱鉴定参与病毒成熟的关键腺病毒蛋白。利用肽丰度分析,从ChAdOx1病毒CsCl超速离心制备的低 (空) 和高密度 (完整) 组分中观察到L1 52/55k丰度的变化约为5倍。L1 52/55k病毒蛋白与DNA包装有关,并在病毒成熟过程中被切割,因此它可能是感染颗粒的标记物。作为腺病毒载体过程监测的一部分,TEM和LC-MS肽图谱是极有应用前景的高分辨率分析表征工具,可以帮助区分空的、非感染性的和感染性病毒颗粒的相对比例,这些结果是一个鼓舞人心的开发进程的第一步,可以更好地区分不同的产品相关杂质。
腺病毒载体有许多治疗和预防用途,包括商业化基因治疗产品和疫苗。它们是一类重要的病毒载体,因为它们可以递送大量核酸有效负载 (8-36 kbp),因此可以实现需要递送大量核酸的治疗性转座子有效载荷进入目标基因组。腺病毒是第一个进入严格治疗开发的 DNA 病毒,因为它具有明确的生物学特性、遗传稳定性、高基因转导效率,且相对容易大规模生产。由于保质期长,它们是很有吸引力的候选疫苗平台,且通过使用不同的添加物和制剂策略,可以进一步延长保质期。
有许多检测方法和技术可用于根据监管指南来表征腺病毒的不同结构属性。当前基于病毒载体的疫苗的质量控制检测方法包括:通过 PCR 进行的颗粒计数、颗粒与感染率的比例(确定通过基于细胞的感染性测定),残留宿主细胞 DNA 和残留宿主细胞蛋白。在这项工作中,我们评估了更高分辨率结构分析的潜在效用,包括液相色谱-质谱法 (LC-MS) 和透射电子显微镜 (TEM) 作为在基于腺病毒的疫苗的工艺开发过程中使用的分析表征工具。这些分析工具提供了更大程度的“互补”产品理解,TEM 提供了病毒颗粒形态的证据,LCMS 允许测量病毒蛋白质组。
黑猩猩腺病毒 (ChAdOx1) 和人类腺病毒 5 型 (Ad5) 这两种通常用于商业生产的载体在本研究中进行了表征。两种病毒载体均通过氯化铯密度梯度超速离心分离,另外对于 Ad5,还使用了阴离子交换膜层析,以评估纯化腺病毒的异质性。腺病毒生产的问题之一是存在与产品相关的杂质,例如空的和未成熟的(非感染性颗粒)。虽然目前使用的检测方法描述了它们的存在和比例,但它们没有提供可用于阐释其存在的根本原因的信息,而这将有利于在生产过程中合理地设计它们。目前正在进行腺相关病毒 (AAV) 领域的研究,以增加针对 AAV 的哪些特征与效力有关的理解。最近,利用高分辨率天然质谱法研究了几种AAV血清型的组成,发现了具有不同衣壳组成的高度异质性的群体。
腺病毒中的产品相关杂质可能来自病毒颗粒成熟周期的不同阶段,其经历了一系列结构变化(图 1)。这些结构变化由参与衣壳组装、DNA 包装和颗粒成熟的关键腺病毒蛋白控制。关键的腺病毒蛋白及其功能列于表 1 中,作为成熟过程的一部分,许多这些腺病毒蛋白会进行蛋白水解切割。此外,错误包装和蛋白水解裂解可能会产生与产品相关的杂质;空的病毒颗粒可能是在成熟前收获导致的,或者可能是包装过程中由于某些因素阻止成熟而导致的错误结果。成熟过程的时间顺序有许多方面仍未完全了解。
腺病毒壳蛋白 IA、VF 和 VIII 以及核心蛋白 VII、pl 和 TP 作为前体合成,并在组装过程中由腺病毒蛋白酶 (AVP) 加工。定量蛋白质组学研究显示了 AVP 拷贝数,每个病毒颗粒只有7个 AVP 分子。每个病毒颗粒大约需要发生 2000 次切割,导致每个 AVP 拷贝发生约 40 到 300 次切割。这些切割必须在病毒核高度拥挤的环境中发生,因为它们与病毒DNA相互作用。包装支架 L1 52/55k 蛋白预计会被 AVP 切割。未成熟颗粒含有约 50 个全长 L1 52/55k 拷贝,而成熟病毒颗粒中不存在该蛋白。
因此,这些病毒蛋白是腺病毒成熟的潜在指示标志物,可以通过 LC-MS 观察以监测各种 Ad5 颗粒的结构和比例。由于某些表面病毒蛋白的拷贝数较低,因此可能难以通过 LC-MS 进行鉴定。此外,颗粒经历的结构变化可能会导致形态学变化,这些变化可以使用 TEM 观察到。最终,这两种方法可能会用于检测 Ad5 产品杂质和工艺开发的异质性,并且所识别的标记蛋白可能会用于质量控制、GMP 背景中基于 ELISA 的分析的基础。
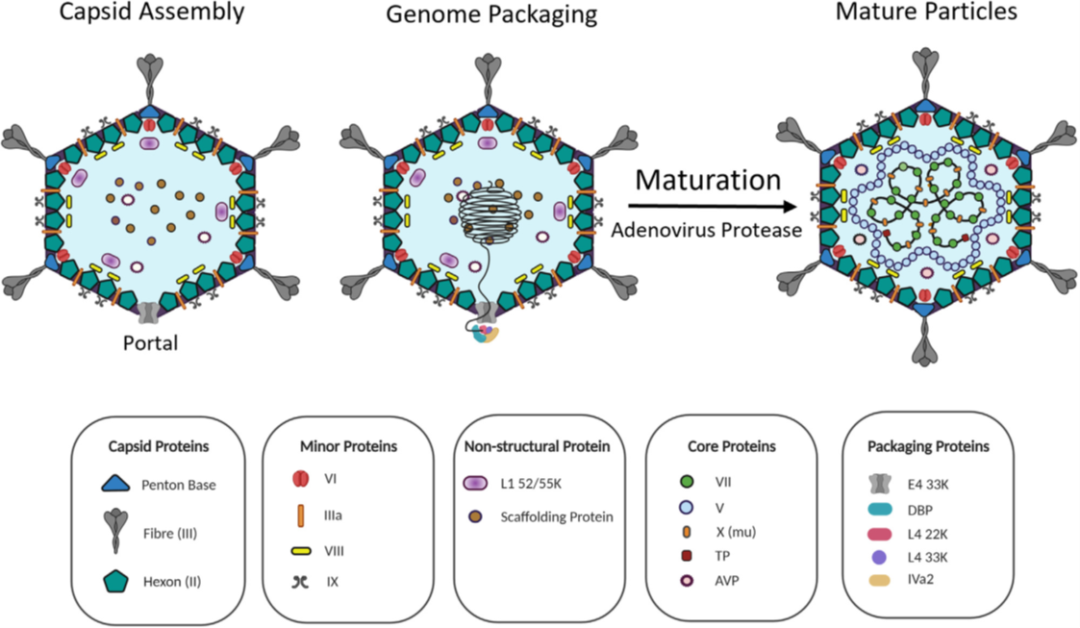
图1. 腺病毒颗粒形成和成熟过程的示意图。衣壳首先由一个顶点作为入口组装。包装蛋白与入口顶点和病毒DNA结合,将DNA运送到组装好的衣壳中。成熟为感染性腺病毒颗粒是通过腺病毒蛋白酶(AVP)裂解关键的腺病毒蛋白和病毒DNA的凝聚而发生的。
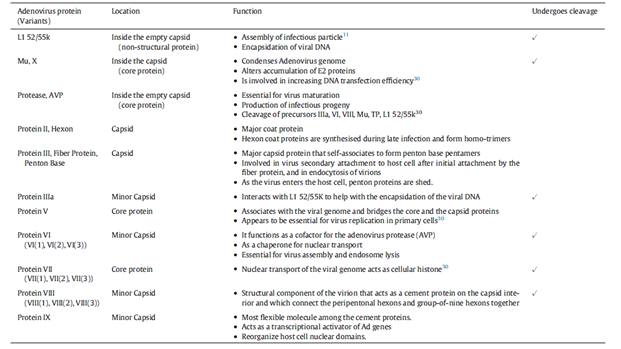
表1. 关键的腺病毒结构蛋白及其功能特性。
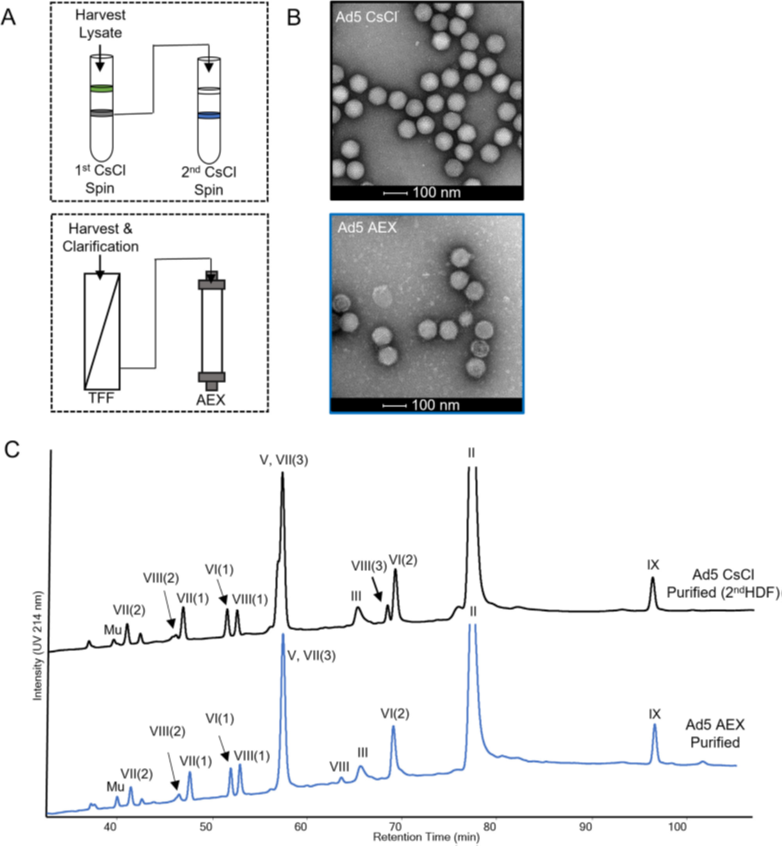
图2. CsCl超速离心或TFF-AEX纯化过程中Ad5样品的外观和组成的表征。(A) Ad5馏分的纯化流程图。(B) Ad5样品的代表性TEM显微图,Ad5样品取自第二次CsCl离心的高密度馏分和AEX洗脱液 (100 nm标尺)。(C) CsCI (黑色)或AEX(蓝色) 纯化Ad5的代表性RP-UHPLC图谱。通过LC-MS肽图鉴定每个峰的Ad5蛋白。
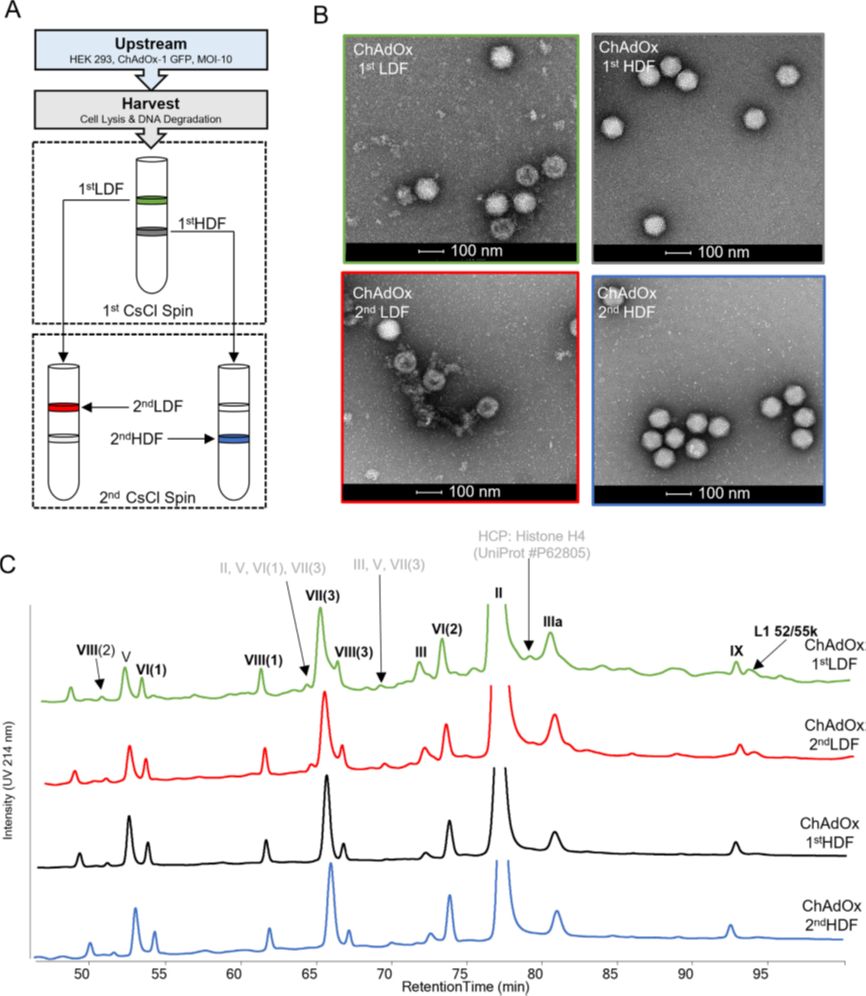
图3. CsCl纯化过程中ChAdOx1-GFP样品的外观和组成表征。(A) ChAdOx1-GFP馏分流程图。(B) 第一或第二个CsCl纯化步骤的 LDF或HDF ChAdOx1-GFP的代表性TEM显微图 (100 nm标尺)。(C) CsCl纯化ChAdOx1-GFP的代表性RP-UHPLC图谱。第一或第二个CsCl离心步骤的低密度部分(LDF) 分别以绿色或红色显示,而第一或第二CsCl步骤的高密度部分 (HDF) 分别以黑色或蓝色显示。
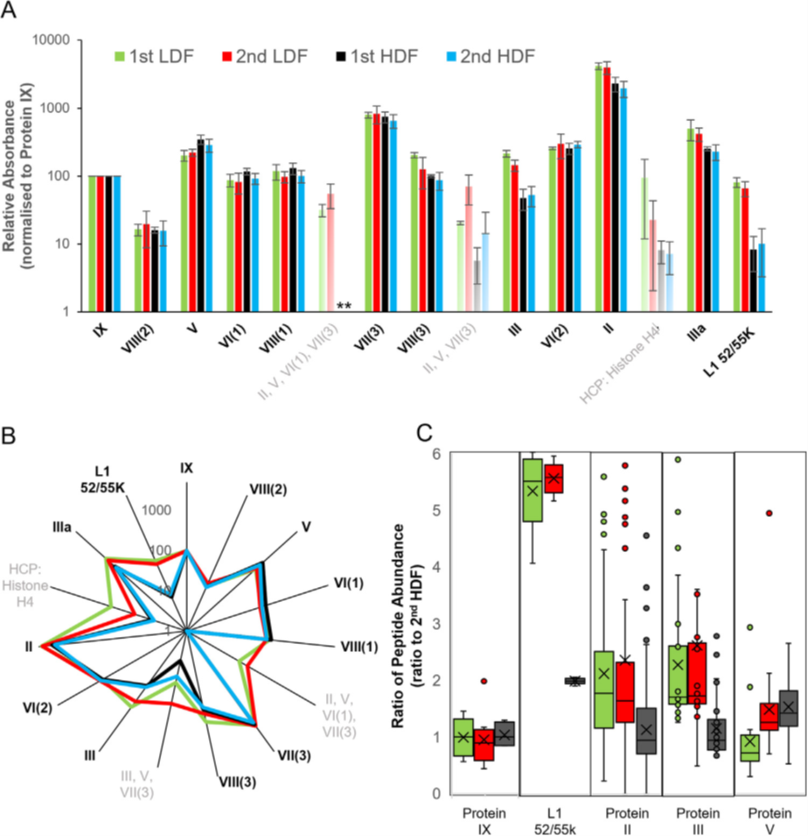
图4. 纯化过程中ChAdOx1-GFP样品LC-MS肽图谱数据集相对蛋白质定量方法的比较。(A)不同ChAdOx1-GFP CsCl组分的相对RP-UHPLC峰比较。各CsCl组分的RP-UHPLC峰丰度归一化为Protein IX峰。误差条表示三次重复的MS测量。星号(*)表示在HDF样本中未观察到的峰值。(B) 图(A)中相同数据集的可视化雷达图。灰色表示的蛋白质低于定量限制。(C) ChAdOx1-GFP CsCl馏分中代表性病毒蛋白的相对肽丰度与第二高密度馏分的两两比较。
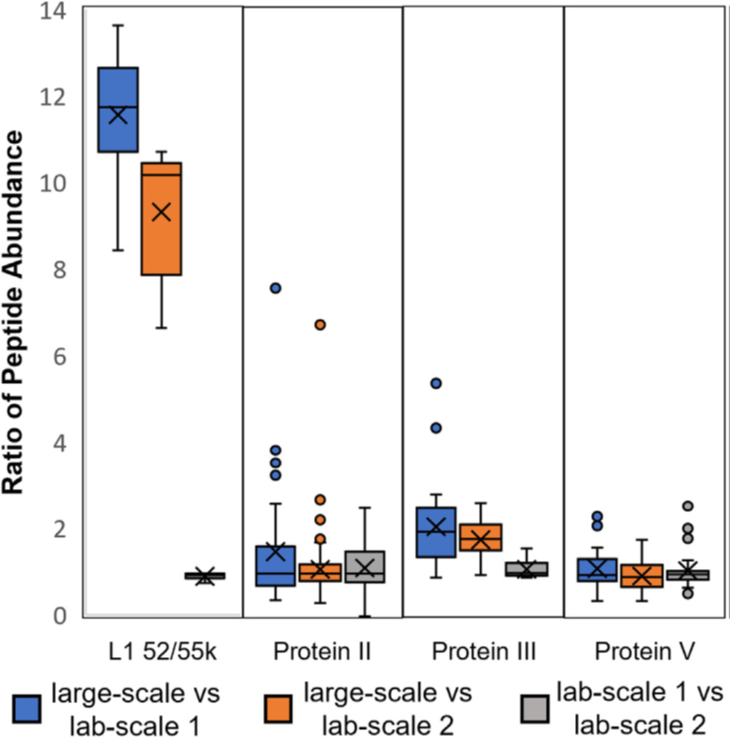
图5. ChAdOx1 nCoV-19肽分析。分析的样品取自一种大规模AEX制剂和两种不同P:l比的实验室规模CsCl制剂,并对四种不同病毒蛋白的肽丰度比进行两两比较。图中显示了3种不同的比较:蓝框-大规模AEX (病毒颗粒:感染性病毒颗粒(P:I)比为97)和实验室规模 CsCl 1 (P:I比为68);橙框-大规模AEX (P: 1比97)和实验室规模CsCl 2 (P: 1比31);灰框-实验室规模CsCl 1 (P:I比例为68)和实验室规模CsCl 2 (P:I比例为31)。
总结
在这项研究中,评估了两种更高分辨率的分析技术,作为在工艺开发过程中表征腺病毒载体质量的潜在工具。首先,人腺病毒血清型 5 (Ad5) TEM 分析表明,在通过 CsCl 超速离心(95% 完整颗粒,P:I 比例 4)或 AEX 层析制备的样品中,更高丰度的完整颗粒与更高(更低)的感染率相关(76% 的完整颗粒,P:I 比例 14)。这种相关性在 CsCl 超速离心制备的 ChAdOx1-GFP 样品中得到证实,样品取自第 1 和第 2 个 LDF(62/45%,P:I 比例 113/77)和第 1 和第 2 个 HDF(93/99%,P:I 比例 79/56)。其次,ChAdOx1-GFP LC-MS 肽图分析还证明了感染率与特定读数(L1 52/55k 的相对丰度)之间的相关性,包括 LDF(5.5/5.6,P:I 比例 113/77) 和 HDF (2.0/1.0, P:I 比例 79/56) 的载体样本。使用通过 CsCl 超速离心或 AEX 层析纯化的 ChAdOx1 载体 (ChAdOx1 nCoV-19) 进一步评估了 LC-MS 肽图分析方法的效用,观察到与 CsCl 样品(P:I 比例为 68 和 31)相比, 在 AEX 样品中(P:I 比例 97)的L1 52/55k 的相对丰度有 10 到 12 倍的差异。总而言之,这项工作中提供的数据显示了通过 TEM 图像分析确定的不完整载体颗粒的比例以及通过 LC-MS 肽丰度分析确定的 L1 52/55K 丰度与使用更标准的基于细胞的技术测量的感染率相关,例如,与 LDF 相比,HDF 样品显示出较低丰度的空(不完整)颗粒和蛋白质 L1 52/55k。虽然呈现的结果是令人鼓舞的第一步,但 TEM 和 LC-MS 肽图分析技术都有可能提供更多关于腺病毒载体样品质量的、数据丰富的数据集,并证明它们作为工艺开发工具的价值。鉴于基于腺病毒的载体的重要性,使用更高分辨率的分析工具更好地了解生产过程及其对产品质量/感染性的影响对于提高生产一致性和降低成本至关重要。
原文:J.M.Hicky, S.I.Jacob, A.S.Tait, et al., Measurement of Adenovirus-based Vector Heterogeneity, Journal of Pharmaceutical Sciences, 2023.






